WikiDer > Гексоза
В химия, а гексоза это моносахарид (простой сахар) с шестью углерод атомы.[1][2] Химическая формула всех гексоз - C6ЧАС12О6, и их молекулярный вес составляет 180,156 г / моль.[3]
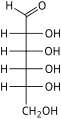
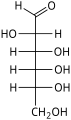
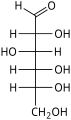
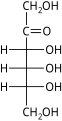
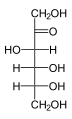
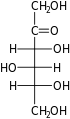
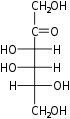
Гексозы существуют в двух формах: с открытой цепью или циклической, которые легко превращаются друг в друга в водных растворах.[4] Открытоцепочечная форма гексозы, которая обычно используется в растворах, имеет общую структуру H– (CHOH)п−1–C (= O) - (CHOH)4−п–H, где п равно 1, 2 или 3. А именно, пять атомов углерода имеют один гидроксил функциональную группу (–OH) каждая, соединенная одинарная облигация, и у одного есть оксогруппа (= O), образующая карбонил группа (C = O). Остальным связям атомов углерода удовлетворяют семь водород атомы. Углероды обычно нумеруются от 1 до 6, начиная с конца, ближайшего к карбонилу.
Гексозы чрезвычайно важны в биохимия, как изолированные молекулы (например, глюкоза и фруктоза) и как строительные блоки других соединений, таких как крахмал, целлюлоза, и гликозиды. Гексозы могут образовывать дигексоза (любить сахароза) реакцией конденсации, которая делает 1,6-гликозидная связь.
Когда карбонил находится в положении 1, образуя формильная группа (–CH = O) сахар называется альдогексоза, частный случай альдоза. В противном случае, если карбонильное положение равно 2 или 3, сахар является производным кетон, и называется кетогексоза, частный случай кетоза; в частности, п-кетогексоза.[1][2] Однако 3-кетогексозы не наблюдались в природе, и их сложно синтезировать;[5] поэтому термин «кетогексоза» обычно означает 2-кетогексозу.
В линейной форме имеется 16 альдогексоз и восемь 2-кетогексозов, стереоизомеры которые различаются пространственным положением гидроксильных групп. Эти виды встречаются парами оптические изомеры. Каждая пара имеет обычное название (например, «глюкоза» или «фруктоза»), а два члена помечены как «D-" или "L- ", в зависимости от того, находится ли гидроксил в положении 5 в Проекция Фишера молекулы, находится справа или слева от оси соответственно. Эти ярлыки не зависят от оптическая активность изомеров. В общем, только один из двух энантиомеров встречается в природе (например, D-глюкоза) и может быть метаболизируется животными или ферментированный от дрожжи.
Иногда предполагается, что термин «гексоза» включает дезоксигексозы, такие как фукоза и рамноза: соединения общей формулы C
6ЧАС
12О
6-у которые можно описать как производные гексоз путем замены одной или нескольких гидроксильных групп атомами водорода.
Классификация
Альдогексозы
Альдогексозы являются подклассом гексоз, которые в линейной форме имеют карбонил у углерода 1, образуя альдегид производная со структурой H – C (= O) - (CHOH)5-ЧАС.[1][2] Самый важный пример: глюкоза.
В линейной форме альдогексоза имеет четыре хиральные центры, которые дают 16 возможных альдогексоз стереоизомеры (24), состоящий из 8 пар энантиомеры. Линейные формы восьмерки D-альдогексозы, в Проекция Фишера, находятся
Из этих D-изомеры, все кроме D-альтроза встречается в живых организмах, но распространены только три: D-глюкоза, D-галактоза и D-манноз. В L-изомеры обычно отсутствуют в живых организмах; Однако, L-альтроза была выделена из штаммов бактерии Butyrivibrio fibrisolvens.[6]
Химик Эмиль Фишер говорят[нужна цитата] придумал следующее мнемонический устройство для запоминания указанного выше порядка, который соответствует конфигурации хиральных центров, когда они заказываются как 3-битные двоичные строки:
- Все альтруисты glАдли маke гум яп галлон танкс.
ссылаясь на всеосе altrосе glукоза манос, гупроиграть ядоза галактоза тапроиграть.
При построении в этом порядке проекции Фишера D-альдогексозы можно идентифицировать с помощью 3-значного двоичные числа от 0 до 7, а именно 000, 001, 010, 011, 100, 101, 110, 111. Три битыслева направо указывают положение гидроксилов на атомах углерода 4, 3 и 2 соответственно: справа, если значение бита равно 0, и слева, если значение равно 1.
Диаграммы Фишера восьми L-альдогексозы являются зеркальным отображением соответствующих D-изомеры; со всеми обратными гидроксилами, включая один на углероде 5.
Кетогексозы
Кетогексоза - это кетон-содержащий гексозу[1][2][7] Биологически наиболее важным примером является фруктоза.
В линейной форме 2-кетогексозы имеют три хиральных центра и, следовательно, восемь возможных стереоизомеров (23), состоящий из четырех пар энантиомеров. Четыре D-изомеры:
Соответствующие L формы имеют гидроксилы на атомах углерода 3, 4 и 5 перевернутыми. Ниже приведены изображения восьми изомеров в альтернативном стиле:
3-кетогексозы
Теоретически кетогексозы включают также 3-кетогексозы, в которых карбонил находится в положении 3; а именно H– (CHOH)2–C (= O) - (CHOH)3-ЧАС. Однако известно, что эти соединения не встречаются в природе, и их сложно синтезировать.[5]
В 1897 г. несбраживаемый продукт, полученный обработкой фруктозы базы, особенно гидроксид свинца (II), было дано имя глютоза и утверждалось, что это 3-кетогексоза.[12][13] Однако последующие исследования показали, что это вещество было смесью различных других соединений.[13][14]
Однозначный синтез и выделение 3-кетогексозы, ксило-3-гексулозапо довольно сложному маршруту, о котором впервые сообщил в 1961 г. Г. Юэнь и Дж. Сугихара.[5]
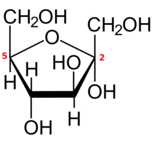
Циклические формы
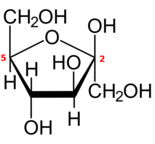
Как и большинство моносахаридов с пятью или более атомами углерода, каждая альдогексоза или 2-кетогексоза также существует в одной или нескольких циклических (с замкнутой цепью) формах, полученных из формы с открытой цепью посредством внутренняя перестановка между карбонильной группой и одной из гидроксильных групп.
Реакция превращает группу = O в гидроксил, а гидроксил в эфирный мост (–O–) между двумя атомами углерода, создавая кольцо с одним кислород атом и четыре или пять атомов углерода.
Если цикл имеет пять атомов углерода (всего шесть атомов), замкнутая форма называется пираноза, после циклический эфир тетрагидропиран, с таким же кольцом. Если в цикле четыре атома углерода (всего пять), форма называется фураноза после соединения тетрагидрофуран.[4] Обычная нумерация атомов углерода в закрытой форме такая же, как и в форме с открытой цепью.
Если сахар представляет собой альдогексозу с карбонилом в положении 1, реакция может включать гидроксил на углероде 4 или углероде 5, создавая полуацеталь с пяти- или шестичленным кольцом соответственно. Если сахар представляет собой 2-кетогексозу, он может включать только гидроксил в углероде 5 и создает гемикетальный с пятичленным кольцом.
Крышка превращает карбоксильный углерод в хиральный центр, который может иметь любую из двух конфигураций, в зависимости от положения нового гидроксила. Следовательно, каждая гексоза в линейной форме может давать две различные закрытые формы, обозначенные префиксами «α» и «β».
С 1926 года известно, что гексозы в кристаллическом твердом состоянии принимают циклическую форму. Формы «α» и «β», которые не являются энантиомерами, обычно кристаллизуются отдельно как отдельные виды. Например, D-глюкоза образует α кристалл, который имеет удельное вращение + 112 ° и точка плавления 146 ° C, а также β-кристалл с удельным вращением + 19 ° и температурой плавления 150 ° C.[4]
Линейная форма не кристаллизуется и существует лишь в небольших количествах в водных растворах, где она находится в равновесии с закрытыми формами.[4] Тем не менее, он играет важную роль как промежуточный этап между этими закрытыми формами.
В частности, формы «α» и «β» могут преобразовываться друг в друга, возвращаясь к форме с открытой цепью и затем закрываясь в противоположной конфигурации. Этот процесс называется мутаротация.
Химические свойства
Хотя все гексозы имеют схожие структуры и общие свойства, каждая пара энантиомеров имеет свой собственный химический состав. Фруктоза растворима в воде, спирте и эфире.[9] Два энантиомера каждой пары обычно обладают совершенно разными биологическими свойствами.
2-Кетогексозы стабильны в широком диапазоне pH и с первичным pKа 10,28, будут депротонировать только при высоком pH, поэтому они незначительно менее стабильны, чем альдогексозы в растворе.
Естественное происхождение и использование
Наиболее важная в биохимии альдогексоза - это D-глюкоза, который является основным «топливом» для метаболизма многих живых организмов.
2-кетогексозы псикоз, фруктоза и тагатоза происходят естественно как D-изомеры, тогда как сорбоза происходит естественно как L-изомер.
D-Сорбоза обычно используется в промышленном синтезе аскорбиновая кислота.[10] D-Тагатоза - это редкая природная кетогексоза, которая в небольших количествах содержится в продуктах питания.[11] D-Фруктоза отвечает за сладкий вкус многих фруктов и является строительным блоком сахароза, обычный сахар.
Дезоксигексозы
Термин «гексоза» иногда может использоваться для включения дезоксиальдогексоз, которые имеют один или несколько гидроксилы (–OH) заменено на водород атомы (–H). Он назван как родительская гексоза с префиксом "Икс-деокси- ", Икс указывая на углерод с затронутым гидроксилом. Некоторые примеры биологического интереса:
- L-Фукоза (6-дезокси-L-галактоза)
- L-Рамноза (6-дезокси-L-манноза)
- D-Квиновоза (6-дезокси-D-глюкоза), входящая в состав сульфолипид сульфохиновозилдиацилглицерин (SQDG)
- L-Пневмоза (6-дезокси-L-талоз)
Смотрите также
 СМИ, связанные с Альдогексозы в Wikimedia Commons
СМИ, связанные с Альдогексозы в Wikimedia Commons СМИ, связанные с Кетогексозы в Wikimedia Commons
СМИ, связанные с Кетогексозы в Wikimedia Commons- Диоза
- Триоза
- Тетроза
- Пентоза
- Гептоза
- Octose
использованная литература
- ^ а б c d Фисбе К. Линдхорст (2007). Основы химии и биохимии углеводов (1-е изд.). Wiley-VCH. ISBN 3-527-31528-4.
- ^ а б c d Джон Ф. Робит (1997). Основы химии углеводов (1-е изд.). Springer. ISBN 0-387-94951-8.
- ^ Pubchem. "D-Псикоза ". pubchem.ncbi.nlm.nih.gov. Получено 2018-04-26.
- ^ а б c d Роберт Торнтон Моррисон и Роберт Нилсон Бойд (1998): Органическая химия, 6-е изд. ISBN 9780138924645
- ^ а б c Джордж Ю. Юн и Джеймс М. Сугихара (1961): "". Журнал органической химии, том 26, выпуск 5, страницы 1598-1601. Дои:10.1021 / jo01064a070
- ^ Патент США 4966845, Стек; Роберт Дж. "Микробное производство L-altrose », выпущенный 1990-10-30, назначен правительству Соединенных Штатов Америки, министру сельского хозяйства.
- ^ Милтон Орчин, изд. (1980). Словарь органической химии. Вайли. ISBN 978-0-471-04491-8.
- ^ Pubchem. "D-Псикоза ". pubchem.ncbi.nlm.nih.gov. Получено 2018-04-26.
- ^ а б Pubchem. «Фруктоза». pubchem.ncbi.nlm.nih.gov. Получено 2018-04-26.
- ^ а б Pubchem. "Сорбоза, D-". pubchem.ncbi.nlm.nih.gov. Получено 2018-04-26.
- ^ а б Pubchem. «Тагатосе». pubchem.ncbi.nlm.nih.gov. Получено 2018-04-26.
- ^ К. А. Лобри де Брюн и В. Альберда ван Экенштейн (1897): «Действие щелочи на основе сахара. VI: Глутоза и псевдофруктоза». Recueil des Travaux Chimiques des Pays-Bas et de la Belgique, том 16, выпуск 9, страницы 274-281. Дои:10.1002 / recl.18970160903
- ^ а б Джордж Л. Кларк, Хунг Као, Луи Саттлер и Ф. В. Зербан (1949): «Химическая природа глютозы». Промышленная и инженерная химия, том 41, выпуск 3, страницы 530-533. Дои:10.1021 / ie50471a020
- ^ Акира Сера (1962): «Исследования химического разложения простых сахаров. XIII. Разделение так называемой глютозы (3-кетогексозы)». Бюллетень химического общества Японии, том 35, выпуск 12, страницы 2031-2033. Дои:10.1246 / bcsj.35.2031