WikiDer > В-клеточная лимфома маргинальной зоны
В-клеточные лимфомы маргинальной зоны, также известный как лимфомы маргинальной зоны (MZL), представляют собой разнородную группу лимфомы которые происходят от злокачественная трансформация из В-клетки маргинальной зоны.[1] В-клетки маргинальной зоны врожденные лимфоидные клетки которые обычно функционируют путем быстрого монтажа IgM антитело иммунные ответы к антигены например, вызванные инфекционными агентами и поврежденными тканями.[2] Они есть лимфоциты из В-клетка линия, которая зародилась и созрела в вторичные лимфоидные фолликулы а затем перейти к краевые зоны из лимфоидная ткань, связанная со слизистой оболочкой (т.е. MALT), селезенка, или же лимфатический узел. Лимфоидная ткань, связанная со слизистой оболочкой, представляет собой диффузную систему небольших концентраций лимфоидная ткань найдено в различных подслизистая оболочка сайты тело такой как желудочно-кишечный тракт, рот, носовая полость, глотка, щитовидная железа, грудь, легкое, слюнные железы, глаз, кожа и человек селезенка.[3]
В 2016 году Всемирная организация здравоохранения классифицировала MZL на три различных типа. Экстранодальные лимфомы маргинальной зоны (EMZL) - это MZL, которые развиваются в экстранодальных тканях. Большинство EMZL развиваются при MALT и часто называются экстранодальными MZL лимфоидной ткани, ассоциированной со слизистой оболочкой, или, проще говоря, MALT-лимфомами. Лимфомы маргинальной зоны селезенки (SMZL) - это MZL, которые изначально ограничиваются селезенкой, костным мозгом и кровью.[1] Узловые лимфомы маргинальной зоны (NNMZ) - это MZL, изначально ограниченные лимфатическими узлами, Костный мозг, и кровь.[1] Хотя все эти MZL включают злокачественные В-клетки, они различаются не только тканями, в которые они вовлечены, но и своими патофизиология, клинические проявления, прогнозы и лечение.[1][4]
MZL составляют 5-17% от всех Неходжкинские лимфомы при этом экстранодальные, селезеночные и узловые формы составляют 50-70%, ~ 20% и ~ 10% всех MZL.[5] Три подтипа MZL чаще встречаются у пожилых людей (в возрасте 65–68 лет) и представляют собой вялотекущие заболевания, которые у людей без симптомов могут изначально лечиться бессимптомно. бдительное ожидание стратегия. Однако NMZL имеет несколько худший долгосрочный результат, чем другие подтипы.[1] и любой из подтипов MZL в небольшом проценте случаев может прогрессировать до более агрессивной лимфомы, особенно диффузная В-клеточная лимфома большого размера.[6] Одной из наиболее отличительных черт MZL является то, что многие случаи связаны с постоянным моделированием иммунной системы хроническим воспаление что сопровождает инфекции[7] или же аутоиммунные заболевания.[8] Случаи MZL, связанные с некоторыми инфекционными патогены можно вылечить лечением, направленным на патогены, вызывающие эти инфекции или связанные с ними.[7]
Лимфома экстранодальной маргинальной зоны
EMZL представляют собой форму MZL, при которой B-клетки злокачественной маргинальной зоны первоначально инфильтрируют MALT-ткани желудка (50-70% всех EMZL) или, реже, пищевод, тонкий кишечник, толстая кишка, прямая кишка, конъюнктива глаза, носовые проходы, глотка, легкое бронхи, вульва, влагалище, кожа, грудь, вилочковая железа, мозговые оболочки (т.е. мембраны), которые охватывают мозг и спинной мозг, или другие органы.[7][9] Эти EMZL подразделяются на подтипы в зависимости от вовлеченного органа (ов). Например, ЭМЗЛ желудка называется первичной ЭМЗЛ желудка. Независимо от подтипа, эти EMZL имеют схожие патофизиологический (т.е. неупорядоченный физиологические процессы которые вызывают болезнь) и гистопатологический (т.е. микроскопический особенности больных ткани). Однако подтипы различаются по проявлениям, прогрессированию, серьезности, лечению и побуждающим факторам. В следующих двух разделах описаны общие патофизиологические и гистопатологические особенности, обнаруженные у всех подтипов EMZL. В этих двух разделах описаны особенности, характерные для каждого подтипа EMZL.
Патофизиология
В развитии EMZL участвует множество факторов. В небольшом количестве случаев заболевание чаще встречается у пациентов, у которых в семейном анамнезе есть гематологические злокачественные новообразования, особенно лейкемия, или различные аутоиммунные заболевания, такие как синдром Шегрена и Красная волчанка. Унаследованные генетические факторы, общие факторы окружающей среды и другие, еще не идентифицированные, факторы могут лежать в основе этих повышенных рисков развития EMZL.[10] Еще одним ключевым фактором в возникновении многих случаев EMZL является хроническое воспаление, вызванное хронической инфекцией или аутоиммунной реакцией. Хроническое воспаление стимулирует В-клетки перестраивать свои локус тяжелой цепи иммуноглобулина так что они кодируют В-клеточные рецепторы которые распознают неестественные антигены, представленные поврежденными объектами и / или инфекционными агентами, лежащими в основе воспаления. Эта перестройка приводит к тому, что В-клетки реагируют на абормальные антигены, приобретая черты маргинальных В-клеток и чрезмерно пролиферируя.[11] Как следствие, эти В-клетки постепенно приобретают хромосомные аномалии, ген мутации, и / или нерегулируемые гены, которые способствуют их злокачественному развитию. Приобретенные геномные аномалии, обнаруженные в EMZL, наряду с частотой встречаемости в определенных подтипах EMZL, включают следующее.
- Хромосомные транслокации: 1) Перемещение длинной (или "q") руки хромосома 11 в положении 21 с плечом q хромосомы 18 в положении 21 (обозначено как транслокация t (11; 18) (q21; q21)) встречается в 24% желудка, 38% легких и редко в других подтипах EMZL. Эта транслокация помещает часть API2 ген с частью MALT1 ген для создания ген слияния кодирует Api2-Malt1 гибридный белок. Этот химерный белок способствует непрерывной активации фактор транскрипции, NF-κB. NF-κB контролирует экспрессию различных генов, которые увеличивают выживаемость, цитокин производство и другое потенциально злокачественное поведение клеток. 2) Транслокация t (14; 18) (q32; q21) происходит в 7% придатков глаза, 6% легких и редко, если вообще возникает, в других случаях EMZL. Это вызывает сверхэкспрессию Malt1. Этот белок косвенно подавляет запрограммированная гибель клеток для продления выживаемости клеток, а также способствует активации NF-κB. 3) Транслокация t (1; 14) (p22; q32) («p» означает короткое плечо хромосомы) происходит в ~ 9% легких, ~ 4% желудка и редко, если вообще возникает, в других случаях EMZL. . Эта транслокация вызывает сверхэкспрессию BCL10 ген. Белок Bcl10 способствует активации NF-κB. 4) Транслокация t (3; 14) (p13; q32) происходит в редких случаях EMZL и, как полагают, вызывает сверхэкспрессию FOXP1 ген. Белок FoxP1 стимулирует выработку факторы транскрипции Такие как PRDM1, IRF4, и XBP1 которые способствуют созреванию В-клеток до плазматических клеток. 5) Три транслокации: t (1; 14) (p21; q32), t (5; 14) (q34; q32), t (9; 14) (p24; q32) и t (X; 14) (p11 .4; q32), встречаются в редких случаях EMZL, но их влияние на развитие злокачественности неизвестно.[12]
- Инактивации и мутации генов: 1) Инактивация или TNFAIP3 ген из-за его делеции на хромосоме 6 в положении 23 (то есть делеция 6q23) или его мутации возникают в основном в придатках глаза, слюнной железе и EMZL щитовидной железы. TNFAIP3 инактивация обычно имеет место в случаях, когда отсутствуют какие-либо из перечисленных выше транслокаций хромосом. Продукт этого гена, фактор некроза опухоли, альфа-индуцированный белок 3, действует, чтобы нарушить активацию NF-κB. 2) Прирост функции мутации в MYD88 ген встречается примерно в 5% случаев EMZL придатков глаза. Продукт этого гена, первичный ответ миелоидной дифференцировки 88, постоянно активирует NF-κB, а также STAT3 и AP1 факторы транскрипции.[12] 3) Инактивирующие мутации в NOTCH1 (8% всех случаев) и NOTCH2 (8% всех случаев) гены встречаются в EMZL. Продукты этих генов рецептор клеточной поверхности белки, которые, будучи связанными со своими активирующими лигандами, перемещаются в ядро клетки и способствуют активации генов, которые контролируют развитие, пролиферацию, выживание и миграцию В-клеток.[13]
Многие подтипы EMZL связаны с инфекционными агентами или аутоиммунными заболеваниями, которые могут способствовать их злокачественному развитию. В следующей таблице представлены данные об этих подтипах EMZL; ткани, которые они затрагивают; инфекционные агенты / аутоиммунные заболевания, которые могут лежать в основе развития подтипов EMZL; сила доказательств, связывающих эти инфекционные агенты / аутоиммунные заболевания с их злокачественными новообразованиями; заболеваемость (т.е. процент) случаев подтипа EMZL, связанных с инфекционным агентом / аутоиммунным заболеванием; и некоторые из химерные гены экспрессируется неопластическими B-клетками подтипа EMZL.
| Подтип | Вовлеченная ткань (ы) | Инфекционный агент или аутоиммунное заболеваниеn[7] | Сила доказательств | Заболеваемость[7][14] | Экспрессия химерных генов (процент случаев)[14] | |
|---|---|---|---|---|---|---|
| Первичная ЭМЗЛ желудка | желудок | Helicobacter pylori | подтвержденный[7][15] | ~80% | BIRC3-MALT1 (23%), IGH-FOXP1 (3%), IGH-BCL-10 (2%), и IGH-MALT1 (1%) | |
| Первичная ЭМЗЛ желудка | желудок | Helicobacter heilmannii sensu lato | скорее всего[7][14] | <1% | похожи на антибиотики, используемые для Helicobacter pylori[16] | |
| Первичная слюнная железа ЭМЗЛ | слюна и слезные железы | Синдром Шегрена | подтвержденный[7][17] | ~4.3% | IGH-MALT1 (6%), BIRC3-MALT1 (2%), и IGH-BCL-10 (1%) | |
| Первичная ЭМЗЛ щитовидной железы | щитовидная железа | Тиреоидит Хашимото | подтвержденный[7][17] | ~0.5% | ICH-FOXP1 (50%) и BIRC3-MALLT1 (9%) | |
| Первичные придатки глаза EMZL | окулярная аденекса (т.е. орбита, конъюнктива, и веки) | Chlamydia psittaci | наводящий на размышления[7][18] | 10-50% | IGH-FOXP1 (20%), IGH-MALT1 16%), и BIRC3-MALT1 (7%) | |
| Первичная кожная ЭМЗЛ | кожа | Borrelia burgdorferi | наводящий на размышления[18] | Переменная | IGH-FOXP1 (10%), IGH-MALT1 (7%), и BIRC3-MALT1 (4%) | |
| Первичная ЭМЗЛ тонкого кишечника | тонкий кишечник | Campylobacter jejuni | низкий[18][3] | Переменная | BIRC3-MALT1 (19%) и IGH-BCL10 (7%) | |
| Первичная легочная ЭМЗЛ | легкое | Achromobacter xylosoxidans | низкий[19][20] | <50% | BIRC3-MALT1 (45%), IGH-BCL10 (8%), и IGH-MALT1 (7%) |
Гистопатология
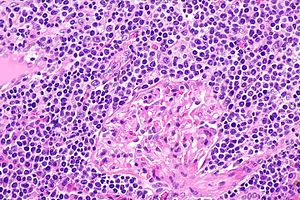
В гистопатологический (т.е. микроскопическое) исследование ЭМЗЛ поражения обычно выявляет неопределенно узловатую или диффузную структуру клеток. Злокачественные клетки в этих поражениях в различных пропорциях имеют морфология лимфоцитов малого и среднего размера, центроцит-подобные В-клетки, центробласт-подобные В-клетки, моноцит-подобные В-клетки, плазматическая ячейка-подобные В-клетки и / или большие В-клетки. Когда большие В-клетки образуют выступающие пласты, которые четко отделены от клеток с другой, низкосортной злокачественной морфологией, болезнь может трансформироваться в гораздо более агрессивное злокачественное новообразование. диффузная В-клеточная лимфома большого размера. Это преобразование происходит у ~ 18% пациентов в среднем через 4–5 лет после первоначального диагноза EMZL.[21] Иммунофенотипирование или неопластические большие В-клетки в этих поражениях показывают, что они экспрессируют CD20 но нет CD3 поверхностная мембрана Белки-маркеры В-клеток. Клетки почти всегда выражают BCL2 и может выразить MNDA (~ 70% случаев), CD23 (~ 33% случаев) и CD5 (~ 20% случаев) маркерные белки, но не экспрессируют циклин D1 маркерный белок.,[21] маркер Т-клеток, CD10, или же BCL6.[1]
Подтипы, диагноз, лечение и прогноз
Существуют различные подтипы EMZL в зависимости от вовлеченных органов. Почти все эти подтипы встречаются в лимфоидной ткани, связанной со слизистой оболочкой пораженного органа, и часто называются MALT-лимфомами пораженного органа (например, MALT-лимфомой желудка). Однако эти лимфомы также называют первичными ЭМЗЛ пораженного органа (например, первичная ЭМЗЛ желудка). Хотя оба термина используются здесь для этих подтипов, первичный (вовлеченный орган) EMZL является предпочтительным для обозначения того, что подтип EMZL первоначально развился в указанной ткани и может оставаться ограниченным ею. Однако примерно в 30% случаев происходит распространение на другие участки, преимущественно в лимфатические узлы, а в редких случаях - на лимфатические узлы. Костный мозг. Злокачественные В-клетки этих подтипов также могут циркулировать в крови, но это очень редко. Независимо от подтипа EMZL или его распространения в другие ткани, прогноз для этих лимфом хороший с 5-летней общей выживаемостью, как правило, от 86% до 95%.[14][6]
Первичный желудочный
Первичная EMZL желудка, также называемая первичной MALT-лимфомой желудка или, чаще, просто MALT-лимфомой желудка, обычно является вялотекущим заболеванием, которое примерно в 10% случаев также затрагивает другие участки желудочно-кишечного тракта и / или не-желудочно-кишечного тракта. Пациенты обычно обращаются на ранней стадии заболевания.[22] с различными симптомами, такими как тошнота, рвота, расстройство желудка, боль в верхней части живота и желудочное кровотечение, на что указывает кашель с кровью, кровавый стул, и / или железодефицитная анемия. Редко пациенты обращаются с перфорация желудка или же B симптомы такие как лихорадка и ночные поты. Лица с хроническим Helicobacter pylori инфекция также может иметь галитоз.[23] Эндоскопический осмотр и биопсия очагов поражения[15] и эндоскопическое ультразвуковое исследование[22] осмотр верхних отделов желудочно-кишечного тракта выявляет поражения, чаще всего в желудке пилорический антрий, то есть поверхностные эрозии слизистой оболочки, неглубокие язвы, узелки, увеличенные морщинки, и / или утолщение стенки желудка.[15] Гистопатология первичных поражений MALT желудка, а также маркерные белки и геномные аномалии, экспрессируемые злокачественными клетками в этих поражениях, приведены в разделе «Гистопатология». Первичная ЭМЗЛ желудка связана с инфицированием желудка Helicobacter pylori в> 80% случаев или с Helicobacter heilmannii sensu lato в <1% случаев.[14] Показания к желудочному Helicobactor pylori Причины ЭМЗЛ желудка включают: положительный дыхательный тест на мочевину; положительный анализ стула что обнаруживает антиген возбудителя в кале пациента; положительный уреазный тест в биопсийном образце ткани; положительный анализ сыворотки или цельной крови с использованием специфических антитела направлен против возбудителя; и рост возбудителя в тканевые культуры биопсии ткани.[24] Helicobacter heilmannii sensu lato обозначает не менее 11 различных Хеликобактор виды, 5 из которых, как известно, поражают желудок человека. Было труднее определить, что Helicobacter heilmannii sensu lato является ответственным за желудочное заболевание человека, поскольку дыхательный тест на мочевину реже дает положительный результат при заражении этими видами, антитела, направленные против них, обычно отсутствуют, и их трудно выращивать в культуре. Диагноз Helicobacter heilmannii sensu lato следовательно, зависит от обнаружения организма в тканях или фекальном материале гистологически с использованием специальных методов окрашивания серебром и последующего секвенирования определенных генов (например, уреазы A, уреазы B, белка теплового шока 60 и / или субъединицы B гиразы) в ДНК организмов и / или организмов 23sРНК.[16] «Лечение локализованных (т.е. Сцена в Анн-Арборе I и II) Helicobactor pylori-положительный первичный желудочный ЭМЗЛ использует один из нескольких различных Helicobacter pylori протоколы ликвидации. Эти протоколы включают ингибитор протонной помпы (например. омепразол или же лансопразол[25]) плюс любой из нескольких антибиотик комбинации (например, Кларитромицин + Амоксициллин или же левофлоксацин + нитазоксанид + доксициклин).[15] Точная схема приема лекарств выбирается на основе известной или предполагаемой устойчивости возбудителя к этим антибиотикам в отдельных случаях. Режим назначается в течение 7–14 дней с последующим тестированием в течение 4 недель на наличие патогена путем выдыхания мочевины или анализа стула на антиген. Если первоначальная схема лечения не способна уничтожить патоген, пациенты проходят лечение по второй схеме с использованием комбинации из трех или четырех препаратов (например, ингибитор протонной помпы + субцитрат висмута + тетрациклин + метронидазол).[15] Ликвидация возбудителя проходит успешно в 70-95% случаев. Недавно была введена последовательная схема лечения (т.е. ингибитор протонной помпы + амоксициллин, а затем ингибитор протонной помпы + кларитромицин + Тинидазол), как сообщается, уничтожает патоген более чем в 90% случаев.[15] Пациенты с поражениями, которые содержат хромосомную транслокацию t (11; 18) или t (1; 14) и поэтому экспрессируют химерный белок BIRC3-MALT1 или IGH-BCL10, соответственно, имеют повышенную вероятность устойчивости к Helicobactor pylori протоколы ликвидации.[14] Примерно у 50-80% пациентов, у которых была эрадикация патогена, в течение 3-28 месяцев развивается ремиссия и длительный клинический контроль лимфомы. Радиационная терапия к желудку и окружающим (т.е. перижелудочным) лимфатическим узлам успешно лечит: а) локализованный Helicobactor pylori-положительный первичный EZML желудка, при котором патоген не был ликвидирован указанными протоколами лечения; б) локализованный Helicobactor pylori-отрицательные случаи первичной EZML желудка; и в) Helicobactor pylori-положительные и -отрицательные случаи EZML у пожилых или ослабленных пациентов. Пациенты с системной (например, стадия III и IV по Анн-Арбору) первичной ЭМЗЛ желудка без симптомов получали лечение бдительное ожидание или если симптоматическое лечение лечили иммунотерапия препарат, средство, медикамент, ритуксимаб (дается на 4 недели) в сочетании с хлорамбуцил дают на 6–12 месяцев; 58% этих пациентов достигают 58% выживаемости без прогрессирования заболевания через 5 лет. Пациенты с ослабленным здоровьем III / IV стадии успешно лечились ритуксимабом или циклофосфамид один.[1] Пока лечение Хеликобактор heilmanni sensu lato зависит от гораздо меньшего количества исследований, обычно следует рекомендациям, используемым для лечения Helicobactor pylori.[16]
Первичный тонкий кишечник
Первичная MZL тонкого кишечника, также называемая первичной MALT-лимфомой тонкой кишки, обычно проявляется колики боль в животе, диарея, а в случае запущенных признаков и симптомов заболевания нарушение всасывания (например, потеря веса, недоедание, и анемия), малые непроходимость кишечника, асцит (т.е. жидкость в брюшной полости) и / или увеличение лимфатических узлов, селезенки и / или печени.[26] Хотя заболевание в целом прогрессирует, у пациентов с первичным MZL тонкого кишечника на ранней стадии могут наблюдаться спонтанные и полные ремиссии.[7] Иммунопролиферативное заболевание тонкого кишечника, ранее называвшейся средиземноморской лимфомой или считавшейся типом болезнь альфа-тяжелых цепей (IgA / αHCD),[27] является вариантом и наиболее распространенной формой MZL тонкого кишечника.[26] Этот вариант эндемичный в странах Средиземноморский бассейн, особенно те из Средний Восток хотя случаи этой болезни были обнаружены во всем мире обычно, но не всегда у иммигрантов с Ближнего Востока.[26] В эндемичных районах иммунопролиферативное заболевание тонкого кишечника составляет ~ 30% всех лимфом желудочно-кишечного тракта, в основном поражает лиц в возрасте 20–30 лет с низким социально-экономическим статусом и связано с инфекцией, передаваемой через пищевые бактерии, Campylobacter jejuni. Campylobacter jejuni-ассоциированное заболевание чаще встречается у лиц, которые человеческий лейкоцитарный антиген AI19, B12 или A9 или группа крови Б. Предполагается, что эти люди генетически предрасположены к развитию болезни.[18] Иммуноокрашивание поражений тонкой кишки в этих случаях обычно обнаруживает наличие Campylobacter jejuni и позволяет прогнозировать, что болезнь подействует на антибиотики. Однако неясно, является ли эта бактерия реальной причиной иммунопролиферативного заболевания тонкого кишечника:[26] он может просто колонизировать кишечник людей с этим заболеванием, в то время как другие, еще не идентифицированные, чувствительные к антибиотикам бактерии или небактериальные патогены, например паразиты, лежат в основе развития болезни.[26]
В случаях первичной ЭМЗЛ тонкого кишечника, двухбаллонная энтероскопия и капсульная эндоскопия выявляют наличие обширных эрозий слизистой оболочки и / или, реже, полипов, узелков, новообразований и / или рубцов.[22] Эти поражения локализуются в двенадцатиперстной кишке, тощей кишке или подвздошной кишке примерно в 63, 17 и 8% случаев соответственно или затрагивают более одного участка тонкой кишки примерно в 17% случаев.[26] Поражения состоят из лимфоцитов, атипичных плазматические клетки и, реже, центроцит-подобные клетки инфильтраты в кишечнике собственная пластинка[18] с лимфоцитами и центроцитоподобными клетками, экспрессирующими маркерные белки (например, CD20 и CD79a), которые типичны для EMZL.[26] Campylobacter jejuni обнаруживается в этих поражениях иммуноокрашивание. Пациенты с этим заболеванием обычно имеют моноклональная гаммопатия в качестве доказательства наличия моноклональное антитело состоящий из фрагмент кристаллизующейся области из IgA тяжелая цепь в их крови, соке тощей кишки и / или, реже, в моче. Аномальный белок IgA обнаруживается в сыворотке крови пациентов иммунофиксация с использованием антитела, направленного против фрагмента тяжелой цепи IgA.[26]
Лечение первичной ЭМЗЛ тонкого кишечника сосредоточено на нутритивной поддержке и контроле симптомов, включая хирургическое вмешательство и / или лучевую терапию для лечения непроходимости кишечника и сильно локализованных заболеваний. Однако исследования показывают, что у людей с этим заболеванием, особенно у людей с иммунопролиферативной формой заболевания тонкой кишки, общая частота ответа составляет ~ 90% после лечения антибиотики широкого спектра действия такие как тетрациклин, метронидазол или тетрациклин + ампициллин.[3] Эти ответы в большинстве случаев устойчивы. Соответственно, антибиотикотерапия рекомендуется для лечения ранней стадии заболевания. Пациенты, невосприимчивые к терапии антибиотиками, получали химиотерапию (т.е. НАРЕЗАТЬ или режимы, подобные CHOP) с последующей длительной поддерживающей терапией тетрациклином. Благодаря этой схеме лечения общая пятилетняя выживаемость составила 70%. Поскольку хирургическое вмешательство и лучевая терапия не излечивают болезнь, режимы химиотерапии с высокими дозами и трансплантация аутологичных стволовых клеток рекомендованы при рефрактерных и / или рецидивирующих заболеваниях.[2]
Колоректальные ЭМЗЛ
ЭНЗЛ, поражающие толстую или прямую кишку, встречаются крайне редко. В обзоре 73 случаев 2019 года люди с диагнозом одного из этих подтипов ENZL имели средний возраст 62 года (диапазон 26-72), были преимущественно женщинами (66%), и их первичные опухоли располагались в прямой кишке (74%). случаев), правой ободочной кишки (13,6%), поперечной ободочной кишке (4,1%) или сигмовидной кишке (8,2%). У 30% этих людей были множественные опухоли, ~ 40% из которых находились в желудочно-кишечном тракте за пределами толстой и прямой кишки. Эти люди первоначально прошли лечение и достигли полной ремиссии с помощью местной хирургической резекции в 18 из 19 случаев, более обширной хирургической резекции в 18 из 19 случаев, химиотерапии в 12 из 13 случаев, лучевой терапии (в 4 из 5 случаев или антибактериальной терапии для достижения Helicobacter pylori искоренение в 12 из 15 случаев. Два человека не получали лечения, у одного из них произошла спонтанная ремиссия. В 8 случаях, не достигших полной ремиссии, потребовалось лечение второй линии; 3 случая - ремиссии неудач.[28] В следующих разделах более подробно описаны эти два подтипа EMZL.
Первичная толстая кишка
Первичная EMZL толстой кишки, также называемая первичной лимфомой MALT толстой кишки, обычно проявляется на ранней стадии заболевания с признаками кровотечения из нижних отделов желудочно-кишечного тракта (например, дегтеобразной дефекацией и / или железодефицитной анемией), реже с болью в нижней части живота и редко с перфорация кишечника или же инвагинация. При эндоскопическом обследовании чаще всего обнаруживается единичный полип или редко множественные полипы, язва слизистой оболочки или узелок слизистой оболочки. Диагноз ставится на основании биопсии поражений с гистологией, типичной для EMZL, например. диффузные инфильтраты, состоящие из лимфоцитов малого и среднего размера, которые могут иметь морфологические особенности моноцитов и / или плазматических клеток. Лимфоциты в этих поражениях экспрессируют маркеры В-клеток (например, CD19 и CD79a), типичные для поражений EMZL. Лучшая схема лечения этой лимфомы обсуждается. Применялись хирургическая резекция, эндоскопическая резекция, лучевая терапия и химиотерапия. Операция с последующей химиотерапией (митоксантрон + хлорамбуцил + преднизон или же циклофосфамид + винкристин + преднизон в сочетании с хлорамбуцилом или ритуксимаб) считаются препаратами первой линии для лечения этого заболевания. Совсем недавно было обнаружено, что только ритуксимаб в качестве единственного агента успешно лечит первичную MALT-лимфому толстой кишки. Наконец, редкие случаи первичной ЭМЗЛ толстой кишки были полностью излечены с помощью Helicobacter pylori антибактериальная терапия.[9]
Первичный ректальный
Первичная ректальная ЭМЗЛ, чаще называемая MALT-лимфомой прямой кишки, обычно проявляется на ранней стадии заболевания анальным кровотечением и / или кровь в стуле. Эндоскопическое исследование выявляет полип прямой кишки, новообразование прямой кишки или, реже, язву прямой кишки.[9] Сообщалось, что в некоторых случаях эта лимфома спонтанно регрессирует.[29] При осмотре> 90% случаев обнаруживаются с локализованным заболеванием (то есть I или II стадии). Поражения лимфомы характеризуются реактивными лимфоидными фолликулами, инфильтрованными центроцитоподобными или моноцитоподобными В-клетками (последние клетки могут проявлять особенности плазматические клетки). Злокачественные клетки в этих поражениях могут содержать транслокацию t (11; 18) и, следовательно, экспрессировать химерный белок API2-MALT1 (11% случаев). Около 22-45% случаев связаны с Helicobactor pylori Инфекция желудочно-кишечного тракта.[30] Лечение заболевания включало лучевую терапию, хирургическую резекцию, эндоскопическую резекцию слизистой оболочки, различные химиотерапевтические методы и устранение антибиотиков. Helicobactor pylori. Эрадикационная терапия при Helicobactor pylori-положительные случаи с использованием рекомендованных в настоящее время стандартных схем лечения антибиотиками дали полные ответы в 12 из 19 случаев и, следовательно, считаются надлежащим лечением в таких случаях. Хирургическая резекция при локализованном заболевании в отдельных случаях обеспечивает долгосрочную выживаемость.[30] Однако лучевая терапия при локализованном заболевании дала 5-летнюю безрецидивную и общую выживаемость 76% и 96% соответственно в 16 из 19 рассмотренных случаев.[30] и предлагается в качестве предпочтительного лечения для пациентов, страдающих Helicobactor pylori-положительная первичная ректальная ЭМЗЛ.[9]
Первичный пищевод
Первичная ЭМЗЛ пищевода, также называемая MALT-лимфомой пищевод, встречается крайне редко, в большинстве случаев сообщается из Японии. Он проявляется симптомами затрудненного глотания и / или ощущением инородного тела в области пищевода. Эндоскопия, эндосонография и грудь Компьютерная томография выявить единичное образование в пищеводе разного размера[31] или, что чаще, линейное центральное углубление или гребень в пищеводе.[32] В обзоре 2017 г. у 6 из 18 пациентов с ЭМЗЛ пищевода были доказательства одновременного Helicobacter pylori инфекционное заболевание.Гистопатология поражений в EMZL пищевода типична для EMZL, показывая присутствие центроцитоподобных клеток, моноцитоподобных клеток и малых лимфоцитов, которые экспрессируют CD20, но не CD10.[31] Лечение EMZL пищевода состояло из эндоскопической резекции, хирургической резекции, лучевой терапии, эндоскопической резекции плюс лучевая терапия или химиотерапия. Большинство пациентов демонстрируют полный ответ на эти вмешательства. Однако долгосрочная эффективность этих ответов неизвестна, поскольку время последующего наблюдения за лечением было коротким (6–35 месяцев). Систематическая эрадикационная терапия на основе антибиотиков для лечения Helicobactor pylori-ассоциированная ЭМЗЛ пищевода не сообщалось[31] пока недавний случай заболевания не лечили фонопразан + амоксициллин + кларитромицин на 1 неделю. Пациент показал доказательства уничтожения бактерии на основании дыхательного теста с мочевиной, но, тем не менее, впоследствии показал прогрессирование лимфомы.[33]
Первичные придатки глаза
Первичный окуляр придаток EZML (также называемый первичной EMZL придатков глаза, первичной лимфомой придатков глаза MALT или первичной лимфомой придатков глаза MALT) встречается в основном у пожилых пациентов (средний возраст 65 лет). Люди могут быть предрасположены к заболеванию из-за длительного контакта с домашним скотом, в основном с крупным рогатым скотом и свиньями, или с использованием мяса этих животных; аутоиммунные заболевания, особенно аутоиммунное заболевание щитовидной железы; и инфекции, особенно Clamydophelia psittaci, коммуникабельный внутриклеточный бактерия поражает диких птиц, сельскохозяйственных животных и людей. У человека вызывает респираторные орнитоз и глазные инфекции, особенно хронические конъюнктивит.[34] Clammydophelia psittaci был обнаружен в поражениях 47-80% пациентов с первичным EMZL придатков глаза, причем самые высокие показатели этого выявления наблюдались в Италии, Австрии, Германии и Корее. О гораздо более низких показателях выявления сообщается в Соединенном Королевстве и Южном Китае, в то время как в случаях из США и Японии было мало или совсем не было доказательств наличия этого микроорганизма.[14] Желудочный Helicobactor pylori инфекция или Вирус гепатита с сообщалось, что инфекция связана с первичным EZZML придатков глаза примерно в 33% и 2-36% случаев соответственно; в редких случаях заболевание также было связано с Вирус простого герпеса 1, Простой герпес 2, аденовирус 8, аденовирус 19, Хламидия трахоматис, или же Chlamydophila abortus инфекционное заболевание. Связь этих инфекций с развитием и / или прогрессированием EZML первичных придатков глаза неясна.[34]
Пациенты имеют конъюнктивальные (25% случаев) или интраорбитальные (75% случаев) поражения, которые обычно затрагивают один глаз, но в 10-15% случаев, особенно в случаях конъюнктивы, поражаются оба глаза. Поражения конъюнктивы обычно представляют собой красное пятно лосося, покрывающее внешний слой глазного яблока; внутриорбитальные поражения обычно проявляются как экзофтальм (т. е. выпуклость глаза) (27% случаев), ощутимый масса глаза (19%), птоз (то есть опущение век) (6%) и / или, реже, диплопия (например, двоение в глазах), нарушение подвижности орбиты, чрезмерное слезотечение и / или орбитальные узелки.[34] Пациенты с заболеванием конъюнктивы могут протекать бессимптомно.[35] Различный процент пациентов с первичным MZL придатков глаза может одновременно страдать от Тиреоидит Хашимото, Синдром Шегрена, или же Заболевание, связанное с IgG4. Некоторые исследования также показали, что болезнь связана с Helicobactor pylori инфицирование желудка (45% случаев) или ЭМЗЛ в других тканях (25% случаев). Поражения первичных придатков глаза EMZL типичны для EMZL: они содержат центроцит-подобные B-клетки, моноцитоподобные B-клетки и / или небольшие лимфоциты, многие из которых экспрессируют белки CD20, CD791, PAZ5 и BCL2, но не белки CD10 или циклин D1.[36] Транслокация хромосомы t (1:14) (p22: q320), которая приводит к сверхэкспрессии MALT1 ген, трисомия 3, трисомия 18 и делеции в положении 23 на длинном плече хромосомы 6 также часто обнаруживаются в первичных придатках глаза EMZL.[34]
Лечение болезни требует дальнейшего изучения. У пациентов с локализованным заболеванием: 1) лучевая терапия дала полный ответ в 52–93% случаев, а частота рецидивов в течение 5 лет без системных (но не местных) рецидивов составила> 90%; 2) химиотерапия с НАРЕЗАТЬ у 15 пациентов была достигнута ремиссия без рецидивов у 9, местный рецидив у 5 и системный рецидив у 2 пациентов после 55 месяцев наблюдения; 3) химиотерапия с хлорамбуцил у 33 пациентов был достигнут полный ответ у 26 пациентов после 24 месяцев наблюдения; 4) иммунотерапия с ритуксимаб достигла переменных результатов в краткосрочной перспективе и требует дальнейшего изучения в течение более длительных периодов наблюдения[36] с несколько лучшими результатами у пациентов с заболеванием конъюнктивы;[34] и 5) антибиотикотерапия с доксициклин достигла 2-летней и 5-летней безотказной выживаемости 67% и 55%, соответственно, и 5-летней безрецидивной выживаемости 61%.[36] Общепризнанным методом выбора для пациентов с системным поражением являются различные схемы химиотерапии, часто в сочетании с ритуксимабом. Полные ответы наблюдались у большинства пациентов, получавших хлорамбуцил, схемы CHOP или ритуксимаб, но частота рецидивов была высокой (например, ~ 33%).[34]
Первичная кожа
Первичная кожная EMZL или первичная кожная лимфома MALT (также называемая лимфома лимфоидной ткани, ассоциированная с кожей) обычно представляет собой один или несколько небольших папулы или же бляшки обычно располагается на руках и / или туловище. Гистологически эти поражения состоят из реактивных зародышевых центров, содержащих смесь небольших В-клеток, которые имеют плазматическая ячейка-вроде или моноцит-подобно морфология переплетается с многочисленными Т-клетка лимфоциты.[37] B-клетки в этих поражениях экспрессируют маркеры B-клеток, обычно наблюдаемые в EMZL.[38] В ДНК из Borrelia burgdorferi, возбудитель Болезнь Лайма, выявляется в очагах поражения у 10–42% пациентов.[39] в Германии, Италии, Японии и Турции, но не у пациентов из Испании, Финляндии, Нидерландов или США.[40] Хотя болезнь почти всегда протекает медленно, она подвержена повторным рецидивам, которые обычно ограничиваются кожей. В редких случаях первичная кожная ЭМЗЛ распространяется на другие ткани и становится системным заболеванием.[40] Лечение первичной кожной ЭМЗЛ было консервативным, учитывая вялотекущее поведение. В Borrelia burdorferi-положительное заболевание, антибактериальная терапия (курсы цефалоспорин или же тетрациклин рассматриваются как выбор антибиотиков первого ряда) следует рассматривать[7] хотя эта мера менее применима в таких регионах, как США, где бактерия не была связана с болезнью.[38] Лечение Borrelia burdorferi-отрицательное заболевание или заболевание, при котором антибактериальная терапия не подходит или не дает результата, зависит от степени поражения. Лечение единичных поражений включает хирургическую резекцию, прямую инъекцию интерферон-альфа или же ритуксимаб в очаги поражения и локализованные дистанционная лучевая терапия. Показатели безболезненности, обнаруженные через 5 и 10 лет после этих курсов лечения, составляют 57% и 43% соответственно. При диссеминированном заболевании бдительное ожидание, внутривенное введение ритуксимаба и химиотерапия. При внутривенном введении ритуксимаб частота ремиссии достигает 85% у пациентов, не получавших химиотерапию; хлорамбуцил химиотерапия с внутривенным введением ритуксимаба или без него значительно улучшила бессобытийную выживаемость; и НАРЕЗАТЬ химиотерапия рекомендуется пациентам с B симптомы (например, лихорадка, ночная потливость, потеря веса и т. д.), повышенный уровень сыворотки дегидрогеназа молочной кислоты, или заболевание, перешедшее в более агрессивную стадию.[7]
Первичное легкое
Первичная легочная ЭМЗЛ (или первичная легочная лимфома MALT) является редким заболеванием, но, тем не менее, составляет до 80% всех лимфом, возникающих в легких. Причина развития этой лимфомы неясна. Около 16% людей с этим заболеванием имеют признаки аутоиммунного расстройства, при этом в одном исследовании сообщается, что 57 из 124 пациентов с этим расстройством имели Achromobacter xylosoxidans ДНК в поражении легких.[41] Achromobacter xylosoxidans это бетапротеобактерии который обычно выделяется из легких кистозный фиброз пациенты; у него низкий вирулентность но чрезвычайно устойчив к антибиотикам.[7] Первичная ЭМЗЛ легких обычно поражает пациентов в возрасте 50–60 лет; почти в 50% случаев заболевание диагностируется у лиц без симптомов, которые поступают с аномальным рентгеновским снимком грудной клетки или компьютерная томография проводится по не связанным с этим причинам.[41] Пациенты с симптомами обычно жалуются на боль в груди, одышку и / или рецидивирующие респираторные инфекции в анамнезе.[14] Рентген грудной клетки и компьютерная томография обычно показывают двустороннюю альвеолярный помутнения менее 5 см. Более серьезное повреждение легких (например, ателектаз, плевральный выпот, или же лимфаденопатия средостения) встречаются <10% случаев. Пациенты с более запущенным заболеванием могут иметь Костный мозг поражение (13-30% случаев), поражение или другие участки за пределами легких, такие как желудок, глаза, уши, нос и / или горло (25-35% случаев), или в редких случаях особенно агрессивное заболевание, системный B симптомы например лихорадка, ночные поты, и / или потеря веса. А моноклональная гаммопатия (т.е. чрезмерное количество моноклональный гамма-глобулин в кровь) обнаруживается в 20-60% случаев, особенно у людей с поражениями тканей, содержащих лимфоциты, которые имеют вид плазматических клеток. Поражения при первичной легочной лимфоме находятся на слизистой оболочке бронхеальные дыхательные пути и диагностируются с помощью игольной биопсии, бронхиальной биопсии, трансбронхиальной биопсии и / или бронхоальвеолярный лаваж. Результаты, согласующиеся с диагнозом, включают образцы биопсии, обнаруживающие инфильтраты слизистой оболочки малых B-клеток, несущих типичные маркеры B-клеток, обнаруженные в EMZL; случайные образцы состоят из B-лимфоцитов с видом плазматических клеток. Бронхоальвеолярный лаваж жидкость может содержать> 10% клеток, несущих эти маркеры. В-клетки в легочных поражениях имеют транслокацию t (11; 18) (q21; q21) и поэтому экспрессируют химерный белок API2-MALT1 примерно в 40% случаев. Другие, менее часто встречающиеся геномные аномалии в этих клетках включают транслокации t (1; 14) (p22; q32), t (14; 18) (q32; q21) и t (3; 14) (p14.1; q32). и трисомия хромосом 3 и / или 18.[41]
Лечение первичной легочной ЭМЗЛ различается. Антибактериальная терапия не изучена и не может быть рекомендована. Рекомендуемые методы лечения, которые обеспечили общую 5-летнюю выживаемость 89-100%[42] включают хирургию, лучевую терапию, химиотерапию, иммунотерапия, и бдительное ожидание.[41] При локализованном заболевании можно рассмотреть возможность хирургической резекции или лучевой терапии. При более обширном заболевании иммунотерапия ритуксимабом дает 70% -ный ответ, но с высокой частотой рецидивов (~ 36%). Лечение с флударабин, НАРЕЗАТЬ, хлорамбуцил, или хлорамбуцил + ритуксимаб использовались для лечения обширного заболевания, при этом каждое лечение давало примерно одинаковую общую среднюю продолжительность жизни> 10 лет.[41]
Первичная слюнная железа
EMZL первичной слюнной железы (также называемая MALT-лимфомой слюнные железы) или, в случаях, прежде всего связанных с слезные железыEMZL первичной слезной железы (также называемая MALT-лимфомой слезной железы) является осложнением Синдром Шегрена, аутоиммунное заболевание характеризуется хроническим воспалением слюнных и / или слезных желез.[17] Считается, что это аутоиммунное заболевание вызывается комбинацией: генетический и относящийся к окружающей среде факторы, включая инфекционные агенты. Эта лимфома поражает ~ 3% пациентов с синдромом Шегрена.[8] и вовлекает одну или несколько пораженных слюнных или, реже, слезных желез.[17] Среднее время между постановкой диагноза аутоиммунного заболевания и EMZL колеблется в пределах 7,5[17] и 11 лет.[19] Пациенты, страдающие заболеванием, обычно в возрасте 55–60 лет, у них наблюдается локальное затвердевание и / или увеличение околоушной железы или, реже, другой слюнной или слезной железой. Около 20% случаев присутствуют или прогрессируют в поражении локальных лимфатических узлов или селезенки, что вызывает лимфаденопатия или же спленомегалия в то время как ~ 10% случаев выявляются или прогрессируют до лимфомы высокой степени, в первую очередь диффузной крупноклеточной В-клеточной лимфомы.[17] Гистологически пораженные железы обнаруживают поражения на основе лимфоцитов, которые типичны для EMZL, с инфильтрирующими лимфоцитами, в некоторых случаях имеющими морфологические признаки, напоминающие плазматические клетки. У людей с более запущенным заболеванием эти поражения развиваются на слизистой оболочке глазница, полость носа, глотка, дыхательные пути нижних дыхательные пути, желудок и / или щитовидная железа.[8]
Лечение первичной ЭМЗЛ слюнной / слезной железы не стандартизировано. Меньшая часть пациентов лечилась бдительное ожидание но большинство пациентов подверглись хирургическому вмешательству, лучевой терапии, химиотерапии (т.е. хлорамбуцил), иммунотерапия (т.е. ритуксимаб, или их комбинацию (например, хлорамбуцил + ритуксимаб или флударабин + ритуксимаб или бендамустин + ритуксимаб) иммунотерапия плюс режим химиотерапии. В целом, общая выживаемость после 5, 10 и 15 лет лечения составила 95%, 85% и 78% соответственно. Хотя реакция на эти терапевтические схемы была очень хорошей, у ~ 33% пациентов, прошедших лечение, наблюдались рецидивы лимфомы в слюнных / слезных железах, лимфатических узлах или других участках.[19]
Лимфоэпителиальный сиаладенит
Лимфоэпителиальный сиаладенит, также называемый хроническим сиаладенитом, представляет собой доброкачественную инфильтрацию слюнных желез B-клетками с морфологическими особенностями B-клеток, центроцитов и моноцитов маргинальной зоны. Гистологически это заболевание связано с атрофия из столбчатый эпителий в протоках слюнных желез, а также разрастание эпителиальных клеток и лимфоэпителиальные поражения в этих железах. Хотя эти гистологические находки обычно являются компонентом синдрома Сьоргена, они также могут возникать у пациентов без признаков этого синдрома. Очень редко лимфоэпителиальный сиаладенит прогрессировал до ЭМЗЛ слюнной железы.[14]
Первичная щитовидная железа
Первичная EMZL щитовидной железы, также называемая MALT-лимфомой щитовидная железа, крайне редко. Это происходит почти исключительно в щитовидной железе, пораженной: Тиреоидит Хашимото, аутоиммунное заболевание, характеризующееся накоплением лимфоцитов, включая B-клетки, в щитовидной железе и последующим разрушением этими клетками ткани щитовидной железы.[43] Пациенты с этим синдромом имеют в 40–80 раз повышенный риск развития лимфомы щитовидной железы, 25% из которых являются первичными EMZL щитовидной железы. Пациенты с тиреоидитом Хашимото, у которых развивается эта лимфома, как правило, женщины (средний возраст 70 лет), которые болеют тиреоидитом в течение 20-30 лет и имеют быстрое увеличение размера щитовидной железы и, в связи с этим, развиваются охриплость, высокий звуки дыхания, и / или затруднение глотания и / или дыхания.[17] Гистологически поражения в этой лимфоме обычно состоят из реактивных лимфоидные фолликулы и лимфоэпителиальные поражения которые заселены В-клетками среднего размера, центроциты, плазматические клетки, и в ~ 1/3 случаев листы крупных лимфоцитарных клеток, подобные тем, которые наблюдаются в диффузные большие В-клеточные лимфомы. Злокачественные клетки в этих поражениях экспрессируют маркеры B-клеток, которые типичны для EMZL, например CD20 и BCL-6, но не белки CD10.[44] Пациенты с первичной ЭМЗЛ щитовидной железы имеют повышенный риск развития более диссеминированной лимфомы, особенно диффузной крупноклеточной В-клеточной лимфомы или, альтернативно, узловой MZL или MZL селезенки.[17]
Лечение первичной ЭМЗЛ щитовидной железы обычно консервативное, так как до 90% пациентов диагностируются на ранней стадии.[17] Хотя оптимальное лечение этого заболевания не определено, большинство пациентов с локализованным заболеванием лечат хирургическим вмешательством, лучевой терапией или комбинацией обоих методов и достигают общих показателей ответа до 100%.[19] и приблизительно 95% -ная 5-летняя выживаемость без болезней.[17] Хирургия плюс лучевая терапия, по-видимому, не дает лучших результатов, чем одна лучевая терапия.[44] Пациенты с обширным заболеванием или заболеванием, которое прогрессировало до лимфомы более высокой степени (преимущественно диффузная B-клеточная лимфома), получали лечение химиотерапия (обычно НАРЕЗАТЬ[44][45]) и / или иммунотерапия (т.е. ритуксимаб[44]). Однако 5-летняя выживаемость пациентов с диссеминированной первичной ЭМЗЛ щитовидной железы, получавших химиотерапию.[46] или заболевание, которое перешло в более злокачественную лимфому[17] составляют всего 35% и 44% соответственно.
ЭМЗЛ и другие аутоиммунные заболевания
Пациенты, страдающие аутоиммунное заболевание кроме тиреоидита Хашимото также есть повышенный риск развития EZML в одном или нескольких участках ткани. Например, пациенты с системная красная волчанка имеют в 7,5 раз повышенный риск развития ЭМЗЛ по сравнению с населением в целом, и на момент постановки диагноза этого развития средний возраст составляет 50 лет, а системный волчаночный эртиематоз диагностирован в течение 6,7–17,8 лет.[17] Пациенты с ревматоидный артрит,[17] иммунная тромбоцитопеническая пурпура,[47] и аутоиммунная гемолитическая анемия[48] аналогичным образом подвержены развитию EZML. Хотя точные причины этих ассоциаций неясны, обычно считается, что хроническое воспаление, связанное с каждым заболеванием, способствует злокачественному поведению B-клеток и, следовательно, развитию EZML.[17] Лечение пациентов с аутоиммунным заболеванием, осложненным EMZL, обычно включает стандартные меры, используемые для лечения как аутоиммунного заболевания, так и EMZL.[48]
Первичная центральная нервная система
Первичная ЭМЗЛ Центральная нервная система крайне редкое заболевание. По сравнению с другими лимфомами центральной нервной системы, которые очень агрессивны, первичная EMZL центральной нервной системы является неагрессивной лимфомой низкой степени злокачественности. В обзоре 70 опубликованных случаев заболевание включало пролиферацию злокачественных В-клеток маргинальной зоны в твёрдая мозговая оболочка, то есть толстая мембрана, окружающая головной и спинной мозг (56 случаев), головной или спинной мозг. паренхима (6 случаев), мозг кавернозный синус (4 случая), мозги сосудистое сплетение (3 случая), внутри головного мозга [[Желудочковая система [желудочек]] (1 случай), мостомозжечковый угол (2 случая), а Зрительный нерв (2 случая). Пациенты (77% женщин; средний возраст 55 лет, от 18 до 78 лет) имели различные неврологические признаки и симптомы в зависимости от места поражения. Наиболее частыми симптомами были: Головная боль (30 случаев); припадки (22 случая); и визуальные изменения (19 случаев). Реже пациенты поступали с парестезии (т.е. ненормальные кожные ощущения), двигательный дефицит и атаксия, сбои памяти, и головокружение. На момент постановки диагноза не было доказательств наличия ЭМЗЛ вне центральной нервной системы. Злокачественные клетки были обнаружены в спинномозговая жидкость в 5 из 19 проверенных на это случаев.[49] Гистологически поражения при заболевании были типичными для EMZL в том смысле, что они состояли из В-клеток малого и среднего размера, которые экспрессируют CD19, CD20 и CD79a), но не из маркерных белков CD10, CD23 или циклина D1, а также некоторых плазматических клеток и переменное количество реактивных Т-клеток.[49][50] Пятьдесят процентов случаев, проверенных на трисомию хромосомы 3, были положительными.[49]
Лечение локализованного заболевания состояло из хирургического вмешательства, лучевой терапии или комбинации обоих методов, тогда как лечение обширного заболевания центральной нервной системы состояло из химиотерапии, включая интратекальная химиотерапия, с или без операции и / или лучевой терапии. Независимо от схемы лечения, первичный EZML для центральной нервной системы имеет хороший прогноз с полным ответом (CR), возникающим у 77% пациентов и 22% пациентов, живущих с признаками заболевания через 1–86 месяцев наблюдения. Значение системной и интратекальной химиотерапии в лечении болезни неясно и требует дальнейшего изучения.[49]
Первичная грудь
Первичная ЭМЗЛ груди (также называемая первичной MALT-лимфомой груди) - чрезвычайно редкое заболевание. Обычно это проявляется в виде пальпируемого новообразования в груди у пациента без симптомов.[51] Патогистологические находки типичны для EMZL: поражения состоят из В-клеток малого и среднего размера, центроцит-подобные В-клетки, мелкие лимфоидные клетки с некоторыми особенностями плазматические клетки или же моноцитыи зрелые плазматические клетки с лимфоидными клетками в этих поражениях, экспрессирующие CD20 и CD79a, но обычно не маркерные белки CD10, CD43 или BCL6.[52] Для лечения локализованной ЭМЗЛ груди рекомендуются умеренные дозы местной лучевой терапии. Это лечение позволило достичь общей выживаемости> 90%. Учитывая эти результаты и высокую чувствительность ЭМЗЛ к лучевой терапии, мастэктомия не рекомендуется, и для лечения локализованного заболевания обычно не требуется широкого иссечения. Для пациентов с диссеминированным заболеванием варианты лечения включают: бдительное ожидание и химиотерапия (обычно с использованием НАРЕЗАТЬ или режим, подобный CHOP) с лучевой терапией и / или эксцизией или без нее. Эти подходы позволили достичь полной ремиссии заболевания у 9 из 9 пациентов, наблюдавшихся в течение 6–74 месяцев, и у одного пациента, у которого наблюдали в течение 107 месяцев, из-за прогрессирующего заболевания. Другие препараты, используемые для лечения заболевания, включают ритуксимаб, тамоксифен, и оксалиплатин.[51]
Первичные мочевыводящие пути
Начальный мочеиспускательный канал ЕМЗЛ мочевой пузырь и почки встречаются крайне редко, но наиболее часто встречаются в этих органах. Чаще всего они возникают у женщин среднего возраста, у которых в анамнезе есть хронические заболевания. цистит, т.е. воспаление мочевого пузыря из-за инфекция мочевыводящих путей или по другим причинам.[19]
Первичный мочевой пузырь
Симптомы первичной лимфомы мочевого пузыря включают потерю веса, усталость, гематурия, дизурия, никтурия, частое мочеиспускание и боль в животе и / или надлобковый площадь.[53] Однако эта лимфома обычно возникает как диссеминированное заболевание, поражающее другие органы и ткани.[54] Радиологическое обследование и цистоскопия выявляют одну или несколько слизистых оболочек в стенке мочевого пузыря или диффузное утолщение в ней.[19] Гистопатология этих поражений типична для EMZL; они содержат мелкие лимфоциты, некоторые или многие из которых имеют особенности плазматических клеток со злокачественными клетками в этих поражениях, обычно экспрессирующих CD20 и PAX-5, но не маркерные белки CD5 или CD10.[53] Клетки могут также содержать транслокацию t (11; 18) (q21: q 21), типичную для EZML.[54] Лечение первичной ЭМЗЛ мочевого пузыря зависит от степени заболевания. Локализованное заболевание следует подтверждать с помощью, например, Позитронно-эмиссионная томография – компьютерная томография (т.е. ПЭТ / КТ), Магнитно-резонансная томография (т.е. МРТ) таз площадь и Исследование костного мозга. Подтвержденное локализованное заболевание лечится хирургическим путем и лучевой терапией, причем лучевая терапия является явно предпочтительным и наиболее подходящим методом, учитывая высокую чувствительность данной лимфомы к радиации. Однако хирургическая резекция с резекция опухоли мочевого пузыря (например, ТУР) может быть лучшим лечением, когда бесплодие вызывает беспокойство. Диссеминированный и рецидивирующий первичный EMZL мочевого пузыря лечили системной химиотерапией (обычно НАРЕЗАТЬ или CHOP + ритуксимаб режим.[53] Прогнозы при лечении локализованного и диссеминированного заболевания хорошие[19] с долгосрочными (например, до 40 лет) ремиссиями, зарегистрированными для большинства пациентов с локализованным заболеванием и (до 10 лет) для пациентов с диссеминированным заболеванием.[53]
Почка
EMZL почек (т.е. почечная MALT-лимфома, почечная EMZL или почечная MALT-лимфома) встречается в основном у лиц старше 50 лет, но сообщается о лицах в возрасте от 9 лет. В чуть более чем половине зарегистрированных случаев лимфома была локализована в почке или обнаруживалась в почках плюс лимфатические узлы вокруг почки, в других местах ретроперитоний, или вдоль брюшная аорта. Таким образом, эти случаи можно рассматривать как первичные EMZL почек. Остальные случаи имели широко распространенное заболевание, некоторые из которых, по-видимому, связаны с первичной ЭМЗЛ слюнной железы, первичной орбитальной ЭМЗЛ, Helicobactor pylori-ассоциированный гастрит, системная красная волчанка или, возможно, Лимфопролиферативное заболевание, связанное с вирусом Эпштейна – Барра, то есть заболевание с разрастанием лимфоцитов, связанное с инфекцией этим вирусом и предположительно вызванное им.[55] Пациенты могут иметь признаки и симптомы новообразования почек (например, слабая боль в стае и / или нарушение функции почек, что определяется по повышению уровня в сыворотке крови). креатинин). Пока неясно, как лучше всего лечить ЭМЗЛ почек. Зарегистрированные случаи были подвергнуты нефрэктомия и / или химиотерапия.[56]
Первичный желчный пузырь
Начальный желчный пузырь EMZL (то есть лимфома краевой зоны экстранодальной зоны желчного пузыря,[57] первичная MALT лимфома желчного пузыря[58]) является чрезвычайно редким заболеванием, по состоянию на 2017 год в литературе было зарегистрировано только 17 случаев.[58] Характерные черты у лиц (в возрасте 31–84 года, средний возраст 74 года,> 60% женщин) с заболеванием аналогичны тем, которые наблюдаются при других лимфомах и нелимфоматозных формах рака желчного пузыря;[57] к ним относятся боль в верхней правой части живота, тошнота, рвота и примерно в двух третях случаев, желчный камень.[58] Учитывая эти сходства, а также сходства в лаборатории, медицинский ультразвук, а также результаты рентгенологического исследования первичной ЭМЗЛ желчного пузыря по сравнению с другими видами рака желчного пузыря, на которые приходится> 99% случаев рака мочевого пузыря, диагноз первичной ЭМЗЛ желчного пузыря еще не был установлен до операции. Скорее, его диагноз опирался исключительно на обследование желчного пузыря, удаленного хирургическим путем.[58] Поражения в этих желчных пузырях показывают инфильтраты в железе. подслизистая основа которые состоят из маленьких лимфоцитов с вкраплениями лимфоэпителиальные поражения. Лимфоциты имеют маркерные белковые профили (например, CD20 и Bcl-2 положительные; CD5, циклин D1[58] и CD10[57] отрицательный), типичные для EMXL. Холецистэктомия, т.е. хирургическое удаление желчного пузыря, привело к ремиссии у всех пациентов с одним рецидивом в течение периода наблюдения от 2 до 96 месяцев.[58]
Первичный печеночный
Первичная EMZL печени (то есть первичная В-клеточная лимфома экстранодальной маргинальной зоны, первичная лимфома, ассоциированная со слизистой оболочкой печени, первичная лимфома, ассоциированная со слизистой оболочкой печени) является чрезвычайно редкой злокачественной опухолью, составляющей <3% всех первичных лимфом печени.[59] По данным обзора 2019 года, в английской литературе было зарегистрировано только 47 случаев первичной ЭМЗЛ печени.[60] Основываясь на этом обзоре, у лиц с первичной ЭМЗЛ печени было сопутствующее заболевание печени (в основном гепатит B вирусный гепатит или же гепатит С вирусный гепатит, реже, первичный билиарный цирроз или же гепатоцеллюлярная карцинома, и, реже, другие заболевания печени[60] Такие как гепатит А вирусный гепатит. Пациенты (средний возраст 63 года, диапазон 30–85 лет) не имели симптомов (~ 64% случаев) или симптомов (которые могли быть связаны с другими заболеваниями печени), такими как боль в животе, общая слабость, кашель, повышение их уровень в крови ферменты печени, и / или свидетельство наличия одной или нескольких опухолей печени, обнаруженных магнитно-резонансная томография, компьютерная томография, или же позитронно-эмиссионная томография.[60] Эти проявления практически идентичны тем, которые наблюдаются при других формах рака печени.Соответственно, диагноз первичной ЭМЗЛ печени было чрезвычайно сложно поставить без получения ткани хирургическими методами.[59] Гистологическое исследование пораженных тканей печени обычно выявляет диффузные инфильтрации атипичных лимфоцитов малого и среднего размера. Эти инфильтраты, которые могут затрагивать желчные протоки печени, часто содержат лимфоэпителиальные поражения. Иммуногистохимия тестирование этих тканей выявило лимфоциты, которые экспрессировали CD20 и BCL-2, но не CD10 или циклин D1. Хотя оптимальные терапевтические стратегии для этого заболевания не установлены, первичная ЭМЗЛ печени, по-видимому, является вялотекущим раком. Пациенты, перенесшие хирургическую резекцию с химиотерапией или без нее, или ритуксимаб схемы лечения, которые наблюдались в среднем в течение 31 месяца, имели в основном положительные результаты: 92% выжили, 8% умерли от причин, не связанных или только косвенно связанных с их раком, и 11% испытали рецидивы.[60]
ЭМЗЛ, ассоциированная с гепатитом С
EMZL встречается чаще (риск увеличивается примерно в 2,5 раза) у людей с вирус гепатита С-индуцированный гепатит. Лимфома обычно возникает через 15-25 лет (среднее время) после вирусной инфекции и поражает кожу (35% случаев), слюнные железы (25%), придатки глазницы (15%) или, что редко, желудок или другие ткани. Это связано с криоглобулинемия II типа, то есть циркуляция иммунного комплекса, состоящего из поликлональный IgG, моноклональный IgM, и вирусный гепатит С РНК. Этот иммунный комплекс вызывает признаки и симптомы васкулита в 10% случаев. Другие признаки и симптомы расстройства включают те, которые связаны с: хронический гепатит и конкретный подтип EMZL.[61] В редких случаях ЭМЗЛ, ассоциированная с инфекцией вируса гепатита С, представляет собой единичные или множественные мягкие подвижные подкожные узелки.[27] Это проявление встречается в основном у женщин (83% случаев) и пожилых пациентов.[61] У пациентов с этим заболеванием могут быть обнаруживаемые уровни циркулирующего вируса гепатита С.[39] Гистология поражений в EMZL, связанных с инфекцией вируса гепатита C, типична для EMZL.[39] хотя геномные аномалии в злокачественных клетках заболеваний не были четко определены, за исключением их экспрессии транслокации t (14; 18) хромосомы в значительном количестве случаев.[62] Лечение этого заболевания основывалось на искоренении вируса с помощью пегинтерферон-альфас, препараты интерферон-альфа для мобилизации иммунной системы хозяев. Это лечение вылечило вирусную инфекцию примерно в 50% случаев и привело к ремиссии лимфомы в <50% случаев. В последнее время наркотики (например, симепревир, даклатасвир, софосбувир, и дасабувир), которые непосредственно ингибируют репродукцию вируса, вылечили инфекцию и достигли ответа от лимфомы у 100 и 73% пациентов, с общей выживаемостью в течение одного года и выживаемостью без прогрессирования 98 и 75% соответственно. Для пациентов, у которых лимфома не реагирует на эту терапию (~ 25% случаев), рекомендуемые методы лечения включают: ритуксимаб или ритуксимаб + пегинтерферон-альфа. С химиотерапия схемы очень токсичны для пациентов с заболеваниями печени, их следует по возможности избегать при лечении ЭМЗЛ, ассоциированного с инфекцией вируса гепатита С.[61]
Лимфома маргинальной зоны селезенки
Лимфома маргинальной зоны селезенки (SMZL) представляет собой лимфому низкой степени злокачественности, при которой злокачественные B-клетки накапливаются в селезенке, костном мозге и, реже, в кровообращении. Хотя обычно болезнь протекает медленно, около 5-10% случаев трансформируются в гораздо более агрессивные злокачественные новообразования. диффузная В-клеточная лимфома большого размера.[63] В разном процентном соотношении наблюдалось, что SMZL чаще встречается у лиц, хронически инфицированных Вирус гепатита с[62] или страдаете одним из различных хронических аутоиммунных заболеваний или аномалий.[64]
Признаки и симптомы
На момент обращения пациенты (средний возраст 65 лет; диапазон 30–90 лет) обычно демонстрируют увеличение селезенки (75% случаев).[65] У них обычно нет увеличенных лимфатический узел кроме лимфатические узлы вокруг ворот их селезенки.[66] У большинства пациентов отсутствуют системные симптомы, такие как лихорадка, ночные поты, потеря веса или усталость.[65] Анализы крови показывают снижение уровня красных кровяных телец, тромбоциты, и / или лейкоциты в 25% случаев;[65] ненормальная циркуляция IgM миеломный белок в <33% случаев; и в ~ 20% случаев доказательства аутоиммунитет аномалии, такие как циркуляция аутоантитела (т.е. антитела направлено против собственных антигенов пациентов), аутоиммунная гемолитическая анемия, иммунная тромбоцитопеническая пурпура,[65] холодные агглютинины, и / или антикоагулянтные антитела.[64] У людей с SMZL также обычно наблюдается повышенный уровень циркулирующей крови. лимфоциты которые в некоторых случаях могут быть идентифицированы как злокачественные В-клетки; эти злокачественные клетки могут иметь волосовидные выступы, похожие на злокачественные В-клетки, обнаруживаемые в кровообращении пациентов с волосатоклеточный лейкоз.[66] Пациенты с SMZL могут также иметь признаки и симптомы приобретенной болезни фон Виллебранда, ангионевротического отека из-за дефицита ингибитора C1-эстеразы.[64] или вирусная инфекция гепатита С (например, клинический гепатит, циркулирующий вирус гепатита С). Связь инфицирования вирусом гепатита С с SMZL варьируется в зависимости от местоположения и может достигать 10% в некоторых регионах.[62] Наконец, тщательное обследование костного мозга пациента почти всегда обнаруживает карманы или более обширные скопления злокачественных В-клеток.[65]
Патофизиология
Злокачественные клетки, участвующие в SMZL, предварительно идентифицированы как B-клетки, подвергшиеся воздействию антигена. Заболевание, по-видимому, инициируется, по крайней мере, в некоторых случаях, хронической стимуляцией антигеном предшественников В-клеток, которые, таким образом, становятся подверженными антигену. Доказательства этого происхождения получены из исследований, показывающих, что B-клетки SMZL, подвергнутые действию антигена, экспрессируют структурно ограниченные иммуноглобулины и В-клеточные рецепторы (видеть клональный отбор), которые, вероятно, связываются со специфическими, но обычно неидентифицированными антигенами.[67] Кроме того, у пациентов с SMZL часто обнаруживаются аутоиммунные нарушения, такие как нарушение кровообращения. аутоантитела (т.е. антитела направлен против собственных антигенов пациентов), аутоиммунная гемолитическая анемия, иммунная тромбоцитопеническая пурпура,[65] болезнь холодовых агглютининов, циркулирующие антикоагулянтные антитела, приобретенные болезнь фон Виллебранда, и ангеэдема из-за дефицита ингибитора С1-эстеразы.[64] Считается, что связывание неидентифицированных антигенов с рецептором В-клеток, включая те, которые участвуют в указанных аутоиммунных нарушениях, стимулируют пролиферацию В-клеток, долгосрочное выживание и, таким образом, поэтапное приобретение геномных аномалий, которые в конечном итоге вызывают появление антигена. опытные В-клетки стали злокачественными.[63][67][65] Геномные аномалии, которые, как считается, способствуют этой злокачественной трансформации, включают:
- Хромосомные аномалии, такие как: 1) делеции в длинном (т.е. «q») плече хромосомы 7 (обозначенном как del7q) в 30-40% случаев (эта делеция редко встречается в других лимфомах и поэтому используется в качестве маркера SMZL) ;[63] 2) делеция области на коротком (т.е. "p") плече хромосомы 17 в 3-17% случаев, что приводит к потере одного из двух p53 гены, кодирующие подавитель опухолей это действует, чтобы регулировать клеточное выживание; 3) прирост q-плеча хромосомы 3 в 10-20% случаев.[65]
- Мутации в таких генах, как: 1 KLF2 (21% случаев),[63] а фактор транскрипции что косвенно регулирует NF-κB сигнальный путь клеточного выживания, пролиферации и производства стимулирующих клетки цитокины;[68] 2) NOTCH2 (20% случаев),[63] мембранный белок, который регулирует развитие В-клеток маргинальной зоны из их клеток-предшественников и имеет подавитель опухолей активность, способствующая тем самым выживанию клеток;[69] 3) TP53 (14% случаев) фактор транскрипции, косвенно регулирующий пролиферацию клеток и запрограммированная гибель клеток тем самым способствовать выживанию клеток;[63] 4) IGLL5 (14% случаев) с нечеткими функциями;[63] 5) TNFAIP3 (13% случаев), который действует опосредованно, подавляя активацию NF-κB и запрограммированную гибель клеток;[63] и 6) в <10% случаев не менее 16 других генов.[63]
В целом, мутации в сигнальных путях NOTCH, NF-κB и KLF2 оказываются особенно важными в патогенезе SMZL.[64]
Диагностика
Наиболее четкие доказательства диагноза СМЗЛ получают при исследовании селезенки пациентов, полученном спленэктомия. Эти селезенки обычно показывают лимфоидные инфильтраты в белая мякоть и, в меньшей и большей степени, красная мякоть. Эти инфильтраты состоят из мелких лимфоцитов, В-клеток маргинальной зоны, центробласт-подобные В-клетки, моноцит-подобные B-клетки и плазматические клетки. Эпителиоидный-подобно гистиоциты можно найти в красной мякоти. Селезеночные прикорневые лимфатические узлы могут показывать узловые инфильтраты малых лимфоцитов. Тщательное и тщательное исследование костного мозга пациентов обычно выявляет скопления лимфоидных клеток между органами. трабекулы и в его пазухи. Неопластические В-клетки также могут циркулировать в крови пациента. Неопластические клетки во всех этих тканях, аналогичные неопластическим клеткам экстранодального и узлового MZL, экспрессируют CD20, CD27, и BCL2 но нет CD10, CD23, CD5, CD43, CD38, BCL6, циклин D1, или же аннексин A1 маркерные белки. Эти клетки могут также экспрессировать делецию del7q (т.е. делеции в плече q хромосомы 7) в 30-40% случаев.[65] и в меньшем количестве случаев мутировавшие гены, перечисленные в разделе патофизиологии. Хотя диагноз SMZL первоначально был основан на исследовании ткани селезенки, в настоящее время диагноз ставится в большинстве случаев на основании клинических данных плюс исследования костного мозга и / или крови пациентов, которые обнаруживают неопластические B-клетки, которые экспрессируют некоторые из белков и / или геномные аномалии, указанные выше;[65] однако в случаях, трудно диагностируемых на основании результатов исследования костного мозга и крови, требуется исследование селезенки для постановки окончательного диагноза SMZL.[66]
Уход
Учитывая его редкость, систематических и контролируемых исследований по лечению SMZL не проводилось. Текущие рекомендации для этого включают следующее. Бдительное ожидание, то есть отказ от определенного лечения при проведении контрольных осмотров каждые 3–6 месяцев для выявления прогрессирования заболевания. Этот курс рекомендован для ~ 33% пациентов с SMZL, которые обращаются с бессимптомным, непрогрессирующим или медленно прогрессирующим заболеванием. Эти пациенты могут не нуждаться в терапевтических вмешательствах в течение длительного времени. Исторически начальная терапия пациентов с быстро прогрессирующим заболеванием была спленэктомия. Около 90% этих пациентов демонстрируют уменьшение симптомов и улучшение низкого уровня эритроцитов, тромбоцитов и лейкоцитов; у них медиана выживаемости без прогрессирования, 5-летняя общая и 10-летняя общая выживаемость составляли 8,2 года, 84% и 67% соответственно. Однако у этих пациентов не наблюдается изменений в уровнях неопластических B-клеток в крови, у них возникли серьезные осложнения после спленэктомии (например, тромбоз, инфекции), и показатели общей выживаемости не изменились лучше, чем при использовании других стратегий лечения. Соответственно, спленэктомия по поводу SMZL была ограничена случаями значительно симптоматической увеличенная селезенка у пациентов с поражением костного мозга от легкой до умеренной степени и без объемного увеличения лимфатических узлов.[66]
Текущие рекомендации по лечению пациентов с симптоматическим или быстро прогрессирующим СМЗЛ основаны на лекарствах. Ритуксимаб, коммерческое приготовление моноклональное антитело направленный на белок CD20 на В-клетках, значительно активен в отношении SMZL, при краткосрочном лечении (например, ~ 4 недели) достигается общая частота ответа 90-100%, частота полной ремиссии> 50% и 7-летняя выживаемость без прогрессирования 69%. Долгосрочная поддерживающая терапия ритуксимабом, по-видимому, улучшает эти результаты, и пациенты, у которых наблюдается рецидив после терапии ритуксимабом, обычно реагируют на второй курс препарата. До появления ритуксимаба одно лекарственное средство химиотерапия (например. хлорамбуцил, циклофосфамид, флударабин, пентостатин, 2CDA, или же бендамустин) и нескольких схем приема лекарств (т. е. схемы ЦВД циклофосфамид, винкристин, и преднизон, или НАРЕЗАТЬ режим ЦВД плюс доксорубицин) использовались для лечения болезни. Однако текущие исследования показывают, что эти химиотерапевтические агенты не превосходят монотерапию ритуксимабом с точки зрения скорости ответа, а также качества и продолжительности этих ответов.[66] Клиническое исследование фазы II показало, что лечение SMZL комбинацией ритуксимаб + бемдамустин обеспечивает общий ответ и частоту полного ответа 91% и 73%, соответственно, при этом процент ответов сохраняется в течение> 3 лет, выживаемость без прогрессирования и общая выживаемость 93%, 90% и 96% соответственно. Результаты этого исследования, хотя и требуют подтверждения, убедительно свидетельствуют о том, что эту схему с двумя лекарствами следует использовать вместо одного ритуксимаба, указанных схем химиотерапии или ритуксимаба в сочетании с указанными схемами химиотерапии для пациентов с симптоматическим / прогрессирующим СМЗЛ.[70]
Эксперты рекомендуют лечить пациентов с SMZL, у которых также есть вирусная инфекция гепатита C, с помощью препаратов, которые действуют для устранения вируса, в качестве первого подхода. До разработки противовирусных агентов прямого действия в нескольких исследованиях сообщалось, что IFN-α лечение У этих пациентов наблюдалось улучшение не только вирусной инфекции, но и ремиссии (~ 65% случаев) лимфом.[66] Несколько новых противовирусных агентов прямого действия, например гразопревир, даклатасвир, софосбувир, и дасабувир, более эффективны при лечении вирусной инфекции гепатита С[61] и у небольшого числа пациентов они были или, как ожидается, будут более эффективными в обеспечении ремиссии лимфомы у пациентов с инфекцией вируса SMZL плюс гепатит С.[61][66]
Прогноз
SMZL обычно проходит вялотекущим курсом с 10-летней выживаемостью 42-95%.[65] Около одной трети этих смертей не связаны с SMZL, а ~ 5-10 из этих смертей связаны с трансформацией их болезни SMZL в диффузную крупноклеточную лимфому с С-клетками.[66]
Узловая лимфома маргинальной зоны
Узловая лимфома маргинальной зоны (NMZL), ранее называемая моноцитоидной B-клеточной лимфомой, узловой моноцитоидной B-клеточной лимфомой и узловой лимфомой маргинальной зоны с моноцитоидными B-клетками или без них, представляет собой инфильтрацию тканей злокачественными лимфоидными клетками, которые имеют морфологический и фенотипический особенности всех лимфом маргинальной зоны.[71] NMZL отличается от других подтипов лимфом маргинальной зоны своим первичным участием лимфатический узел а не другие ткани и органы.[72] NMZL - наименее распространенный подтип из трех лимфом маргинальной зоны.[73]
Признаки и симптомы
Присутствуют почти все пациенты с NMZL (средний возраст 50–64 года;[71] соотношение мужчин и женщин от 1,5 к 1[73]) с не громоздким увеличением лимфатических узлов в области шеи, паха, живота и грудной клетки;[71] в некоторых случаях эта причастность также может быть Миндалины Вальдейера.[74] Пациенты при поступлении обычно полностью функциональны, но в 10-20% случаев жалуются на B симптомы например лихорадка, ночные поты, потеря веса и / или усталость.[74] Лабораторные исследования показывают, что злокачественные B [клетки, проникающие в Костный мозг у ~ 33% пациентов и аномальный IgM миеломный белок в ~ 20% случаев. Редко у пациентов могут быть циркулирующие злокачественные В-клетки маргинальной зоны и / или снижение одного или нескольких типов нормальных циркулирующих клеток. кровяные клетки.[71] Биопсия пораженных тканей различных типов (например, диффузная по всему лимфатическому узлу, сосредоточенная между фолликулами лимфатических узлов и / или узелки, распространяющиеся по всему лимфатическому узлу) инфильтрация лимфоцитов.[74] Эти закономерности аналогичны тем, которые наблюдаются при лимфомах EMZL MALT.[73] Клетки в этих инфильтратах представляют собой в различной пропорции мелкие лимфоциты, B-клетки, похожие на маргинальную зону, центроцит-подобные клетки, моноцит-подобные клетки, плазматическая ячейка-подобные клетки и в> 20% случаев крупные бластные В-клетки. Злокачественные B-клетки в этих инфильтратах, как и в других лимфомах маргинальной зоны, представляют собой B-клетки маргинальной зоны, которые обычно экспрессируют CD20, CD19, CD79, и Bcl2 но нет CD10, CD5, CD23, или же циклин D1.
Патофизиология
Сообщается, что около 6-19% случаев NMZL связаны с аутоиммунные заболевания Такие как ревматоидный артрит, Синдром Шегрена, аутоиммунная гемолитическая анемияи хронические тиреоидит. Однако существует мало свидетельств того, что эти заболевания способствуют развитию NMZL.[74] Кроме того, ассоциация NMZL с вирус гепатита С инфекции, обнаруженные в более ранних исследованиях, не были подтверждены в более поздних исследованиях.[73] Таким образом, представляется, что постулируемая роль хронической иммунной стимуляции в развитии экстранодальных лимфом и лимфом маргинальной зоны селезенки не была четко продемонстрирована и может не относиться к NMZL: основная исходная причина развития этого заболевания в настоящее время неясна. Тем не менее, стимулирующие B-клетки в NMZL приобретают геномные аномалии, которые, как считается, вносят вклад в их злокачественную трансформацию. Эти геномные аномалии включают следующее.
- Хромосомные аномалии, такие как: 1) трисомия хромосомы 3 (24% случаев), что вызывает сверхэкспрессию FOXP1, НФКБИЗ, и BCL6 чьи белковые продукты способствуют клеточной пролиферации и выживанию;[71] 2) трисомия 18 хромосомы (~ 50% случаев), вызывающая сверхэкспрессию NFATC1[71] белковый продукт которого может способствовать пролиферации и выживанию клеток;[75] 3) редко - трисомия хромосом 7 и 12 и делеция длинного плеча хромосомы 6, функциональные эффекты которых пока неизвестны;[71] и 4) хромосомная транслокация между коротким (т.е. «p») плечом хромосомы 2 в положении 24 и длинным (т.е. «q») плечом хромосомы 14 в положении 32, транслокация, функциональные последствия которой пока неизвестны, но не обнаруживаются в лимфоме другой маргинальной зоны формы и поэтому полезны в качестве диагностического маркера для NMZL.[76]
- Мутации в таких генах, как: 1) NOTCH2 (25% случаев)[63] мембранный белок, который регулирует развитие В-клеток маргинальной зоны из их клеток-предшественников, а также является подавитель опухолей который регулирует выживаемость погреба;[69] 2) TNFAIP3 (5-15% случаев) чей продукт деубиквитинирующий фермент который функционирует, чтобы подавить NF-κB фактор транскрипции и тем самым сигнальный путь NF-κB, который контролирует клеточную активацию, пролиферацию и выживание;[67] 3) BIRC3, который кодирует белок cIAP2, который регулирует гибель клеток, вызванную апоптоз;[67] 3) MYD88 (0-10% случаев) белковый продукт которых косвенно регулирует активацию NF-κB сигнальный путь клетки;[67] 4) KLF2 белок продукта которого является фактором транскрипции, который косвенно регулирует NF-κB сигнальный путь клетки;[67] 5) PTPRD чей продукт белок представляет собой рецепторная тирозинфосфатаза который имеет подавитель опухолей активности и косвенно регулирует несколько сигнальных программ, которые регулируют пролиферацию клеток и ответы на цитокины;[67] и 5) в ~ 40% случаев один или несколько различных других генов, таких как MLL2, SIN3A, ARID1A, EP300, CREBBP, и TBL1XR1) который имеет ремоделирование хроматина активность, тем самым регулируя экспрессию широкого ряда других генов.[67]
Диагностика
Диагноз NMZL зависит от выявления неопластических B-клеток в лимфатических узлах и в некоторых случаях костного мозга, но не, по крайней мере на ранней стадии заболевания, во внеузловых органах. Эти неопластические клетки должны экспрессировать маркерные белки, общие для лимфом маргинальной зоны (см. Предыдущий раздел), и, в большинстве случаев, одну или несколько геномных аномалий, указанных в разделе патофизиологии.[71]
Уход
Рекомендуемые методы лечения NMZL зависят от состояния заболевания. Бессимптомный NMZL может использовать бдительное ожидание с плановыми контрольными обследованиями каждые, например 3–6 месяцев, чтобы проверить прогрессирование заболевания. Однако локализованное заболевание, даже у бессимптомных пациентов, последовательно лечилось хирургическим вмешательством с последующей местной лучевой терапией. Заболевание, которое переходит из локальной стадии в диссеминированное, быстро прогрессирующее заболевание и симптоматическое заболевание, лечилось одним химиотерапевтическим препаратом (например, кладрибин, флударабин, хлорамбуцил, или же бендамустин); один иммунотерапия лекарство (например, ритуксимаб); режим комбинированной химиотерапии (например, НАРЕЗАТЬ), или комбинацию нескольких химиотерапевтических препаратов плюс режим иммунотерапии (например, CHOP + ритуксимаб). Неясно, лучше ли какой-либо один или несколько из этих режимов по сравнению с другими.[73]
Прогноз
NMZL считается неизлечимым, но относительно вялотекущим заболеванием, которое принимает медленно прогрессирующее и рецидивирующее течение. Прогноз несколько хуже, чем при экстранодальных лимфомах и лимфомах маргинальной зоны селезенки.[71] при этом ~ 15% людей прогрессируют до более агрессивной лимфомы, диффузной крупноклеточной В-клеточной лимфомы, в среднем через ~ 4,5 года после постановки диагноза НМЗЛ.[73] Согласно различным исследованиям, 5-летняя выживаемость людей с этим заболеванием составляет 62-90%.[73]
Дети
У детей НМЗЛ классифицирован Всемирная организация здоровья (2016) как отдельный вариант НМЗЛ на основе его презентации, гистология пораженных лимфатических узлов и клинического течения.[73] Из более 60 опубликованных случаев 95% случаев НМЗЛ у детей произошли у мальчиков-подростков, причем> 90% случаев представляли собой бессимптомное локализованное (стадия I / II) заболевание, связанное с увеличением лимфатических узлов в области головы и шеи. Эти случаи не показали связи с аутоиммунными или возбудитель-индуцированные воспалительные заболевания. Все эти данные контрастируют с данными, наблюдаемыми при лимфомах экстранодальной маргинальной зоны, встречающихся у детей. Гистологически пораженные лимфатические узлы показывают инфильтрацию в зародышевые центры пораженных лимфатических узлов лимфоидными клетками, обычно экспрессирующими CD20 и CD43, часто (~ 50% случаев) экспрессирующие Bcl2 и обычно не экспрессирующие CD10 или BCL6. В-клетки маргинальной зоны в этих инфильтратах имеют относительно немного геномных аномалий по сравнению с NMZL у взрослых. Сообщалось о трисомии 18 хромосомы в 21% случаев, а в редких случаях - о трисомии хромосомы 3. В этих клетках не сообщалось о повторяющихся генных мутациях.[77] Течение педиатрической НМЗЛ крайне вяло, при этом заболевание имеет низкую частоту рецидивов и обычно дает отличный результат.[73] Периоды наблюдения продолжительностью до 12–18 лет показали, что общая выживаемость пациентов составляет 100%, а частота рецидивов составляет ~ 4%.[77] Для лечения педиатрической НМЗЛ использовались бдительное ожидание стратегия ритуксимаб, химиотерапия и / или местная лучевая терапия. Стратегия бдительного ожидания сработала так же, как и другие методы лечения, и поэтому является рекомендуемым начальным лечением болезни.[77]
Недавнее исследование
Различные новые препараты, такие как В-клеточный рецептор (см. рисунок рядом) блокираторы сигнализации и ибритумомаб тиуксетан (Zevlin) проходят клинические испытания на MZL.[78] Эти испытания важны для определения дозировок и безопасности исследуемых препаратов. По состоянию на 19 января 2017 г. FDA одобрил первый в истории таргетный препарат для MZL, ибрутиниб.[79] Этот препарат действует, подавляя Тирозинкиназа Брутона (BKT), который способен посылать сигналы ядру для выживания. Другими словами, это замедляет рост В-клетки.[79] Вакцина были разработаны, что значительно сокращает количество Helicobacter pylori в желудке животных, ранее колонизированных этими бактериями. Одна или несколько из этих вакцин могут быть перспективными кандидатами для борьбы с Helicobacter pylori инфекции у людей, а также сельскохозяйственных и домашних животных.[80]
Рекомендации
- ^ а б c d е ж грамм Bron D, Meuleman N (сентябрь 2019 г.). «Лимфомы маргинальной зоны: вторые по распространенности лимфомы у пожилых пациентов». Текущее мнение в области онкологии. 31 (5): 386–393. Дои:10.1097 / CCO.0000000000000554. PMID 31246587.
- ^ а б Тиблемонт С., Зукка Э. (2017). «Клинические аспекты и терапия лимфомы желудочно-кишечного тракта MALT». Лучшие практики и исследования. Клиническая гематология. 30 (1–2): 109–117. Дои:10.1016 / j.beha.2017.01.002. PMID 28288705.
- ^ а б c Шрискандараджа П., Дирден CE (2017). «Эпидемиология и экологические аспекты лимфом маргинальной зоны». Лучшие практики и исследования. Клиническая гематология. 30 (1–2): 84–91. Дои:10.1016 / j.beha.2016.07.002. PMID 28288721.
- ^ Swerdlow SH, Campo E, Pileri SA, Harris NL, Stein H, Siebert R, Advani R, Ghielmini M, Salles GA, Zelenetz AD, Jaffe ES (май 2016 г.). «Пересмотр 2016 г. классификации лимфоидных новообразований Всемирной организации здравоохранения». Кровь. 127 (20): 2375–90. Дои:10.1182 / кровь-2016-01-643569. ЧВК 4874220. PMID 26980727.
- ^ Cheah CY, Opat S, Trotman J, Marlton P (февраль 2019 г.). «Первоочередное лечение вялотекущей неходжкинской лимфомы в Австралии. Часть 2: лимфома из клеток мантии и лимфома маргинальной зоны». Журнал внутренней медицины. 49 (9): 1070–1080. Дои:10.1111 / imj.14268. PMID 30816618.
- ^ а б Казуло С., Фридберг Дж. (2017). «Трансформация лимфомы маргинальной зоны (и ассоциация с другими лимфомами)». Лучшие практики и исследования. Клиническая гематология. 30 (1–2): 131–138. Дои:10.1016 / j.beha.2016.08.029. PMID 28288708.
- ^ а б c d е ж грамм час я j k л м п Смедби К.Е., Понзони М. (ноябрь 2017 г.). «Этиология В-клеточных лимфоидных злокачественных новообразований с акцентом на хроническое воспаление и инфекции». Журнал внутренней медицины. 282 (5): 360–370. Дои:10.1111 / joim.12684. PMID 28875507.
- ^ а б c Ноктюрн Г, Понтарини Э, Бомбардьери М, Мариетт Х (март 2019 г.). «Лимфомы, осложняющие первичный синдром Шегрена: от аутоиммунитета до лимфомы». Ревматология (Оксфорд, Англия). Дои:10.1093 / ревматология / kez052. PMID 30838413.
- ^ а б c d Аббас Х., Ниази М., Маккер Дж. (Май 2017 г.). "Лимфоидная лимфома, связанная со слизистой оболочкой (MALT), лимфома толстой кишки: отчет о болезни и обзор литературы". Американский журнал историй болезни. 18: 491–497. Дои:10.12659 / AJCR.902843. ЧВК 5424574. PMID 28469125.
- ^ Bracci PM, Benavente Y, Turner JJ, Paltiel O, Slager SL, Vajdic CM, Norman AD, Cerhan JR, Chiu BC, Becker N, Cocco P, Dogan A, Nieters A, Holly EA, Kane EV, Smedby KE, Maynadié M , Спинелли Дж. Дж., Роман Э., Глимелиус Б., Ван С. С., Сэмпсон Дж. Н., Мортон Л. М., де Санхосе С. (август 2014 г.). «Медицинский анамнез, образ жизни, семейный анамнез и профессиональные факторы риска лимфомы маргинальной зоны: проект InterLymph по подтипам неходжкинской лимфомы». Журнал Национального института рака. Монографии. 2014 (48): 52–65. Дои:10.1093 / jncimonographs / lgu011. ЧВК 4207869. PMID 25174026.
- ^ Бертони Ф, Росси Д., Зукка Э (2018). «Последние достижения в понимании биологии лимфомы маргинальной зоны». F1000 Исследования. 7: 406. Дои:10.12688 / f1000research.13826.1. ЧВК 5874504. PMID 29657712.
- ^ а б Du MQ (2017). «Лимфома MALT: генетические аномалии, иммунологическая стимуляция и молекулярный механизм». Лучшие практики и исследования. Клиническая гематология. 30 (1–2): 13–23. Дои:10.1016 / j.beha.2016.09.002. PMID 28288707.
- ^ Арруга Ф, Вайситти Т, Деаглио С (2018). «Путь NOTCH и его мутации при злокачественных новообразованиях зрелых В-клеток». Границы онкологии. 8: 550. Дои:10.3389 / fonc.2018.00550. ЧВК 6275466. PMID 30534535.
- ^ а б c d е ж грамм час я Шройдер М.И., ван ден Бранд М., Хебеда К.М., Гроенен П.Дж., ван Крикен Дж.Х., Шайен Б. (декабрь 2017 г.). «Новые разработки в патогенезе и диагностике экстранодальной лимфомы маргинальной зоны». Журнал гематопатологии. 10 (3–4): 91–107. Дои:10.1007 / s12308-017-0302-2. ЧВК 5712330. PMID 29225710.
- ^ а б c d е ж Виолета Филип П., Кучуряну Д., Сорина Дьякону Л., Мария Владареану А., Сильвия Поп С. (2018). «MALT лимфома: эпидемиология, клиническая диагностика и лечение». Журнал медицины и жизни. 11 (3): 187–193. Дои:10.25122 / jml-2018-0035. ЧВК 6197515. PMID 30364585.
- ^ а б c Бенту-Миранда М., Фигейредо С. (декабрь 2014 г.). «Helicobacter heilmannii sensu lato: обзор инфекции у людей». Всемирный журнал гастроэнтерологии. 20 (47): 17779–87. Дои:10.3748 / wjg.v20.i47.17779. ЧВК 4273128. PMID 25548476.
- ^ а б c d е ж грамм час я j k л м п Тейшейра Мендес LS, Wotherspoon A (2017). «Лимфома маргинальной зоны: ассоциированные аутоиммунные и аутоиммунные нарушения». Лучшие практики и исследования. Клиническая гематология. 30 (1–2): 65–76. Дои:10.1016 / j.beha.2016.07.006. PMID 28288719.
- ^ а б c d е Понзони М, Феррери Эй Джей (2017). «Бактерии, ассоциированные с лимфомами маргинальной зоны». Лучшие практики и исследования. Клиническая гематология. 30 (1–2): 32–40. Дои:10.1016 / j.beha.2017.01.001. PMID 28288714.
- ^ а б c d е ж грамм Матутес Э., Монтальбан С. (2017). «Клинические особенности и лечение лимфом маргинальной зоны, не относящейся к желудочно-кишечному тракту, неокулярной экстранодальной слизистой оболочки, связанной с лимфоидной тканью (ENMALT)». Лучшие практики и исследования. Клиническая гематология. 30 (1–2): 99–108. Дои:10.1016 / j.beha.2016.07.005. PMID 28288723.
- ^ Sammassimo S, Pruneri G, Andreola G, Montoro J, Steffanoni S, Nowakowski GS, Gandini S, Negri M, Habermann TM, Raderer M, Li ZM, Zinzani PL, Adam P, Zucca E, Martinelli G (декабрь 2016 г.). «Ретроспективное международное исследование первичной экстранодальной лимфомы маргинальной зоны легкого (BALT-лимфома) от имени Международной группы по изучению экстранодальной лимфомы (IELSG)». Гематологическая онкология. 34 (4): 177–183. Дои:10.1002 / hon.2243. PMID 26152851.
- ^ а б Пилери С, Понзони М (2017). «Патология узловых лимфом маргинальной зоны». Лучшие практики и исследования. Клиническая гематология. 30 (1–2): 50–55. Дои:10.1016 / j.beha.2016.11.001. PMID 28288717.
- ^ а б c Ольшевская-Шопа М, Врубель Т (август 2019). «Желудочно-кишечные неходжкинские лимфомы». Достижения клинической и экспериментальной медицины. 28 (8): 1119–1124. Дои:10.17219 / acem / 94068. PMID 31414733.
- ^ Доу В., Ли Дж., Сюй Л., Чжу Дж., Ху К., Суй З., Ван Дж, Сюй Л., Ван С., Инь Г. (сентябрь 2016 г.). «Галитоз и инфекция Helicobacter pylori: метаанализ». Лекарство. 95 (39): e4223. Дои:10.1097 / MD.0000000000004223. ЧВК 5265885. PMID 27684792.
- ^ Diaconu S, Predescu A, Moldoveanu A, Pop CS, Fierbințeanu-Braticevici C (2017). «Инфекция Helicobacter pylori: старое и новое». Журнал медицины и жизни. 10 (2): 112–117. ЧВК 5467250. PMID 28616085.
- ^ Strand DS, Kim D, Peura DA (январь 2017 г.). «25 лет ингибиторам протонной помпы: всесторонний обзор». Кишечник и печень. 11 (1): 27–37. Дои:10.5009 / gnl15502. ЧВК 5221858. PMID 27840364.
- ^ а б c d е ж грамм час Бьянки Дж., Сохани АР (январь 2018 г.). «Тяжелая цепная болезнь тонкой кишки». Текущие отчеты гастроэнтерологии. 20 (1): 3. Дои:10.1007 / s11894-018-0608-y. PMID 29372346.
- ^ а б Зукка Э., Бертони Ф. (апрель 2016 г.). «Спектр лимфомы MALT на разных участках: биологическая и терапевтическая значимость». Кровь. 127 (17): 2082–92. Дои:10.1182 / кровь-2015-12-624304. PMID 26989205.
- ^ Вон Дж. Х., Ким С. М., Ким Дж. У., Пак Дж. Х., Ким Дж. Й. (2019). «Клинические особенности, лечение и исходы колоректальной лимфоидной лимфоидной ткани (MALT) слизистой оболочки: обзоры литературы, опубликованные на английском языке в период с 1993 по 2017 год». Лечение рака и исследования. 11: 8577–8587. Дои:10.2147 / CMAR.S214197. ЧВК 6759223. PMID 31572011.
- ^ Такенака Р., Томода Дж., Саката Т., Ичиба Т., Мотои М., Мидзуно М., Цудзи Т. (март 2000 г.). «Спонтанно регрессировавшая лимфома из лимфоидной ткани прямой кишки, связанная со слизистой оболочкой». Журнал гастроэнтерологии и гепатологии. 15 (3): 331–5. Дои:10.1046 / j.1440-1746.2000.02086.x. PMID 10764039.
- ^ а б c Кобаяси Т., Такахаши Н., Хагивара Ю., Тамару Дж., Каяно Х., Джин-най И., Бесшо М., Нийцу Н. (январь 2008 г.). «Успешная лучевая терапия у пациента с первичной лимфомой лимфоидной ткани, ассоциированной со слизистой оболочкой прямой кишки, без гена слияния API2-MALT1: описание случая и обзор литературы». Исследование лейкемии. 32 (1): 173–5. Дои:10.1016 / j.leukres.2007.04.017. PMID 17570523.
- ^ а б c Ма Кью, Чжан Ц., Фанг С., Чжун П, Чжу Х, Линь Л., Сяо Х. (март 2017 г.). «Первичная лимфома лимфоидной ткани, ассоциированная со слизистой оболочкой пищевода: отчет о клиническом случае и обзор литературы». Лекарство. 96 (13): e6478. Дои:10.1097 / MD.0000000000006478. ЧВК 5380272. PMID 28353588.
- ^ Табибиан Дж. Х., Калани А., Моран А. М., Панганамамула К. (январь 2019 г.). "Экстранодальная лимфома маргинальной зоны B (MALT) пищевода". Журнал рака желудочно-кишечного тракта. Дои:10.1007 / s12029-018-00187-5. PMID 30618000.
- ^ Takeuchi Y, Miyahara K, Morito T, Okikawa Y, Kinugasa H, Moritou Y, Higashi R, Kunihiro M, Nakagawa M (январь 2019). «Прогрессирование лимфомы лимфоидной ткани, ассоциированной со слизистой оболочкой пищевода, после эрадикационной терапии Helicobacter pylori: отчет о болезни и обсуждение терапевтических вариантов». Внутренняя медицина (Токио, Япония). 58 (2): 207–212. Дои:10.2169 / internalmedicine.1112-18. ЧВК 6378146. PMID 30146577.
- ^ а б c d е ж Сассоне М, Понзони М, Феррери А.Дж. (2017). «Лимфома придаточной зоны глаза: клиническая картина, патогенез, диагностика, прогноз и лечение». Лучшие практики и исследования. Клиническая гематология. 30 (1–2): 118–130. Дои:10.1016 / j.beha.2016.11.002. PMID 28288706.
- ^ Таненбаум Р.Э., Галор А., Дубовый С.Р., Карп С.Л. (2019). «Классификация, диагностика и лечение лимфомы конъюнктивы». Eye and Vision (Лондон, Англия). 6: 22. Дои:10.1186 / s40662-019-0146-1. ЧВК 6660942. PMID 31372366.
- ^ а б c Гаффи Джонсон Дж., Терпак Л.А., Марго К.Э., Сетудех Р. (апрель 2016 г.). «Экстранодальная В-клеточная лимфома краевой зоны придатков глаза». Борьба с раком: журнал онкологического центра Моффитта. 23 (2): 140–9. Дои:10.1177/107327481602300208. PMID 27218791.
- ^ Кемпф В., Циммерманн А.К., Миттельдорф С. (июнь 2019 г.). «Кожные лимфомы - обновление 2019». Гематологическая онкология. 37 Дополнение 1: 43–47. Дои:10.1002 / hon.2584. PMID 31187534.
- ^ а б Wilcox RA (ноябрь 2018 г.). «Кожные B-клеточные лимфомы: обновленная информация о диагностике, стратификации риска и лечении за 2019 год». Американский журнал гематологии. 93 (11): 1427–1430. Дои:10.1002 / ajh.25224. HDL:2027.42/109952. PMID 30039522.
- ^ а б c Феррери А.Дж., Гови С., Понзони М. (декабрь 2013 г.). «Лимфомы маргинальной зоны и инфекционные агенты». Семинары по биологии рака. 23 (6): 431–40. Дои:10.1016 / j.semcancer.2013.09.004. PMID 24090976.
- ^ а б Понзони М., Феррери А.Дж., Маппа С., Пасини Е., Гови С., Факкетти Ф., Фанони Д., Туччи А., Вино А., Доглиони С., Берти Е., Дольчетти Р. (2011). «Распространенность инфекции Borrelia burgdorferi в серии из 98 первичных кожных лимфом». Онколог. 16 (11): 1582–8. Дои:10.1634 / теонколог.2011-0108. ЧВК 3233293. PMID 22071292.
- ^ а б c d е Бори Р., Вислез М., Антуан М., Кадранель Дж. (2017). «Лимфопролиферативные заболевания легких». Дыхание; Международный обзор заболеваний грудной клетки. 94 (2): 157–175. Дои:10.1159/000477740. PMID 28609772.
- ^ Defrancesco I, Arcaini L (март 2018 г.). «Обзор лечения MALT-лимфом не желудка». Лучшие практики и исследования. Клиническая гематология. 31 (1): 57–64. Дои:10.1016 / j.beha.2017.11.001. PMID 29452667.
- ^ Ахмед Р., Аль-Шейх С., Ахтар М. (май 2012 г.). «Тиреоидит Хашимото: век спустя». Достижения в анатомической патологии. 19 (3): 181–6. Дои:10.1097 / PAP.0b013e3182534868. PMID 22498583.
- ^ а б c d Штейн С.А., Вартофски Л. (август 2013 г.). «Первичная лимфома щитовидной железы: клинический обзор». Журнал клинической эндокринологии и метаболизма. 98 (8): 3131–8. Дои:10.1210 / jc.2013-1428. PMID 23714679.
- ^ Ватанабе Н., Наримацу Х., Но Дж.Й., Иваку К., Кунии Й, Сузуки Н., Охе Х., Сузуки М., Мацумото М., Йошихара А., Камеяма К., Кобаяши К., Ками М., Сугино К., Ито К. (февраль 2018 г.). «Долгосрочные исходы 107 случаев первичной лимфомы лимфоидной ткани, связанной со слизистой щитовидной железы, в одном медицинском учреждении в Японии». Журнал клинической эндокринологии и метаболизма. 103 (2): 732–739. Дои:10.1210 / jc.2017-01478. PMID 29165612.
- ^ Пейшото Р., Коррейя Пинто Дж., Соарес В., Кох П., Тавейра Гомеш А. (январь 2017 г.). «Первичная лимфома щитовидной железы: клинический случай и обзор литературы». Анналы медицины и хирургии (2012). 13: 29–33. Дои:10.1016 / j.amsu.2016.12.023. ЧВК 5199157. PMID 28053701.
- ^ Кляйнстерн Г., Авербух М., Абу Сеир Р., Перлман Р., Бен Иегуда Д., Палтиель О. (апрель 2018 г.). «Наличие аутоиммунного заболевания влияет не только на риск, но и на выживаемость пациентов с В-клеточной неходжкинской лимфомой». Гематологическая онкология. 36 (2): 457–462. Дои:10.1002 / hon.2498. PMID 29469175.
- ^ а б Дасану Ц.А., Бокорны Б., Грабска Дж., Кодряну I. (апрель 2015 г.). «Распространенность и характер аутоиммунных состояний у пациентов с лимфомой маргинальной зоны: опыт одного учреждения». Коннектикут Медицина. 79 (4): 197–200. PMID 26259295.
- ^ а б c d Аянамбаккам А., Ибрахими С., Билал К., Черри М.А. (январь 2018 г.). «Экстранодальная лимфома маргинальной зоны центральной нервной системы». Клиническая лимфома, миелома и лейкемия. 18 (1): 34–37.e8. Дои:10.1016 / j.clml.2017.09.012. PMID 29103980.
- ^ Разак В., Гоэль А., Амин А., Гроссбард М.Л. (июнь 2009 г.). «Первичная лимфома лимфоидной ткани, ассоциированная со слизистой оболочкой центральной нервной системы: клинический случай и обзор литературы». Клиническая лимфома и миелома. 9 (3): E5–9. Дои:10.3816 / CLM.2009.n.052. PMID 19525185.
- ^ а б Хиссуру III М., Зия С.Ю., Алкатари М., Штраухен Дж., Бакст Р.Л. (2016). «Первичная MALT-лимфома груди, леченная окончательным облучением». Отчеты о случаях в гематологии. 2016: 1831792. Дои:10.1155/2016/1831792. ЧВК 4877461. PMID 27247809.
- ^ Liguori G, Cantile M, Cerrone M, La Mantia E, Di Bonito M, Zanconati F, Curcio MP, Aquino G, La Mura A, Giannatiempo R, De Chiara A, Lombardi A, Botti G, D'Antonio A, Caraglia M , Франко Р. (октябрь 2012 г.). «Лимфомы молочной железы MALT: клинико-патологическое и цитогенетическое исследование 9 случаев». Отчеты онкологии. 28 (4): 1211–6. Дои:10.3892 / или 2012.1942. PMID 22842723.
- ^ а б c d Вемпати П., Кнолль М.А., Алкатари М., Штраухен Дж., Мэлоун А.К., Бакст Р.Л. (2015). "MALT Лимфома мочевого пузыря: отчет о болезни и обзор литературы". Отчеты о случаях в гематологии. 2015: 934374. Дои:10.1155/2015/934374. ЧВК 4568333. PMID 26417464.
- ^ а б Venyo AK (2014). «Лимфома мочевого пузыря». Достижения в урологии. 2014: 327917. Дои:10.1155/2014/327917. ЧВК 3912819. PMID 24511310.
- ^ Гарсия М., Коноплев С., Моросан С., Абруццо Л.В., Буэсо-Рамос С.Е., Медейрос Л.Дж. (сентябрь 2007 г.). «MALT лимфома почек: отчет о 10 случаях и обзор литературы». Американский журнал клинической патологии. 128 (3): 464–73. Дои:10.1309 / 0T2UKUKV91W3QR6W. PMID 17709321.
- ^ Макино Т., Мива С., Кошида К., Кавасима А. (апрель 2016 г.). "Лимфома лимфоидной ткани, ассоциированная со слизистой оболочкой почек: описание случая и обзор литературы". Журнал Международной онкологической конференции. 5 (2): 82–89. Дои:10.1007 / s13691-015-0234-6. ЧВК 6498318. PMID 31149432.
- ^ а б c Мани Х., Климент Ф, Коломо Л., Питталуга С., Раффельд М., Яффе Э. С. (сентябрь 2010 г.). «Лимфомы желчного пузыря и внепеченочных желчных протоков: клинико-патологические наблюдения и биологические последствия». Американский журнал хирургической патологии. 34 (9): 1277–86. Дои:10.1097 / PAS.0b013e3181e9bb8b. ЧВК 2929270. PMID 20679881.
- ^ а б c d е ж Honda M, Furuta Y, Naoe H, Sasaki Y (май 2017 г.). «Первичная лимфома желчного пузыря, связанная со слизистой оболочкой (MALT), и обзор литературы». Отчеты о делах BMJ. 2017. Дои:10.1136 / bcr-2017-220161. ЧВК 5747624. PMID 28551602.
- ^ а б Болок А., Де Грез Т., Буазза Ф, Де Винд Р., Эль-Хури М., Репулло Д., Донкиер В. (2018). "Первичная лимфома печени, имитирующая гепатоцеллюлярную карциному у пациента с циррозом: отчет о болезни и систематический обзор литературы". Отчеты о случаях в хирургии. 2018: 9183717. Дои:10.1155/2018/9183717. ЧВК 5914115. PMID 29850362.
- ^ а б c d Xie H, Lv J, Ji Y, Du X, Yang X (март 2019). «Первичная лимфома лимфоидной ткани, ассоциированная со слизистой оболочкой печени: отчет о клиническом случае и обзор литературы». Лекарство. 98 (13): e15034. Дои:10.1097 / MD.0000000000015034. ЧВК 6456129. PMID 30921228.
- ^ а б c d е Арман М, Бессон С, Гермин О, Дави Ф (2017). «Вирус гепатита С - ассоциированная лимфома маргинальной зоны». Лучшие практики и исследования. Клиническая гематология. 30 (1–2): 41–49. Дои:10.1016 / j.beha.2017.02.001. PMID 28288715.
- ^ а б c Михайла Р.Г. (июль 2016 г.). «В-клеточная неходжкинская лимфома, ассоциированная с вирусом гепатита С». Всемирный журнал гастроэнтерологии. 22 (27): 6214–23. Дои:10.3748 / wjg.v22.i27.6214. ЧВК 4945980. PMID 27468211.
- ^ а б c d е ж грамм час я j Харамилло Окендо С., Паркер Х, Оссье Д., Эннис С., Гибсон Дж., Стреффорд Дж. К. (июль 2019 г.). «Систематический обзор соматических мутаций при лимфоме маргинальной зоны селезенки». Научные отчеты. 9 (1): 10444. Bibcode:2019НатСР ... 910444J. Дои:10.1038 / s41598-019-46906-1. ЧВК 6639539. PMID 31320741.
- ^ а б c d е Аркаини Л., Росси Д., Паулли М. (апрель 2016 г.). «Лимфома маргинальной зоны селезенки: от генетики к лечению». Кровь. 127 (17): 2072–81. Дои:10.1182 / кровь-2015-11-624312. PMID 26989207.
- ^ а б c d е ж грамм час я j k Пирис MA, Onaindía A, Mollejo M (2017). «Лимфома краевой зоны селезенки». Лучшие практики и исследования. Клиническая гематология. 30 (1–2): 56–64. Дои:10.1016 / j.beha.2016.09.005. PMID 28288718.
- ^ а б c d е ж грамм час Калпадакис К., Пангалис Г.А., Ангелопулу М.К., Вассилакопулос Т.П. (2017). «Лечение лимфомы краевой зоны селезенки». Лучшие практики и исследования. Клиническая гематология. 30 (1–2): 139–148. Дои:10.1016 / j.beha.2016.07.004. PMID 28288709.
- ^ а б c d е ж грамм час Спина В., Росси Д. (2017). «Молекулярный патогенез лимфомы селезенки и узловой маргинальной зоны». Лучшие практики и исследования. Клиническая гематология. 30 (1–2): 5–12. Дои:10.1016 / j.beha.2016.09.004. PMID 28288716.
- ^ Jha P, Das H (ноябрь 2017 г.). «KLF2 в регуляции NF-κB-опосредованной функции иммунных клеток и воспаления». Международный журнал молекулярных наук. 18 (11): 2383. Дои:10.3390 / ijms18112383. ЧВК 5713352. PMID 29125549.
- ^ а б Саката-Янажимото М, Чиба С (2012). «Notch2 и иммунная функция». В Радтке Ф (ред.). Нотч-регуляция иммунной системы. Актуальные темы микробиологии и иммунологии. 360. С. 151–61. Дои:10.1007/82_2012_235. ISBN 978-3-642-24293-9. PMID 22695918.
- ^ Iannitto E, Bellei M, Amorim S, Ferreri AJ, Marcheselli L, Cesaretti M, Haioun C, Mancuso S, Bouabdallah K, Gressin R, Tripodo C, Traverse-Glehen A, Baseggio L, Zupo S, Stelitano C, Castagnari B, Патти С., Альварес И., Либерати А.М., Мерли М., Джини Дж., Кабрас М.Г., Дюпюи Дж., Тессулин Б., Перро А., Ре Ф., Паломби Ф., Гулино А., Зукка Е., Федерико М., Тиблемонт С. (декабрь 2018 г.). «Эффективность бендамустина и ритуксимаба при лимфоме маргинальной зоны селезенки: результаты исследования фазы II BRISMA / IELSG36». Британский журнал гематологии. 183 (5): 755–765. Дои:10.1111 / bjh.15641. PMID 30407629.
- ^ а б c d е ж грамм час я Тиблемонт С., Молина Т., Дави Ф. (апрель 2016 г.). «Оптимизация терапии лимфомы маргинальной зоны». Кровь. 127 (17): 2064–71. Дои:10.1182 / кровь-2015-12-624296. PMID 26989202.
- ^ Цюй Кью, Сюань В., Фань Г.Х. (январь 2015 г.). «Роль резолвинов в разрешении острого воспаления». Cell Biology International. 39 (1): 3–22. Дои:10.1002 / cbin.10345. PMID 25052386.
- ^ а б c d е ж грамм час я Тадмор Т, Поллиак А (2017). «Узловая лимфома маргинальной зоны: клинические особенности, диагностика, ведение и лечение». Лучшие практики и исследования. Клиническая гематология. 30 (1–2): 92–98. Дои:10.1016 / j.beha.2016.08.026. PMID 28288722.
- ^ а б c d ван ден Бранд М., ван Крикен Дж. Х. (июль 2013 г.). «Распознавание узловой лимфомы маргинальной зоны: последние достижения и подводные камни. Систематический обзор». Haematologica. 98 (7): 1003–13. Дои:10.3324 / haematol.2012.083386. ЧВК 3696602. PMID 23813646.
- ^ Рудольф Р., Буш Р., Патра А. К., Мухаммад К., Авотс А., Андрау Дж. К., Кляйн-Хесслинг С., Серфлинг Е. (2014). «Архитектура и экспрессия гена nfatc1 в лимфоцитах». Границы иммунологии. 5: 21. Дои:10.3389 / fimmu.2014.00021. ЧВК 3909943. PMID 24550910.
- ^ Браун А., Сциашия-Висани I, Фаррелл Д., Смит М., Феликс С., Мутараджа В., Руэлл Дж., Тейлор Г. (2019). «Пациент с диагнозом В-клеточная лимфома узловой маргинальной зоны и t (2; 14) (p24; q32) с участием MYCN и IGH». Молекулярная цитогенетика. 12: 3. Дои:10.1186 / s13039-019-0419-3. ЧВК 6359751. PMID 30733831.
- ^ а б c Вессманн В., Кинтанилья-Мартинес Л. (июнь 2019 г.). «Редкие зрелые В-клеточные лимфомы у детей и подростков». Гематологическая онкология. 37 Дополнение 1: 53–61. Дои:10.1002 / hon.2585. PMID 31187530.
- ^ «Лимфома маргинальной зоны - Фонд исследования лимфомы». www.lymphoma.org. Получено 2017-12-10.
- ^ а б «FDA одобрило первое в истории целевое лечение лимфомы маргинальной зоны». Новые разработки при лимфоме. 2017-01-19. Получено 2017-12-10.
- ^ Blosse A, Lehours P, Wilson KT, Gobert AP (сентябрь 2018 г.). «Helicobacter: воспаление, иммунология и вакцины». Helicobacter. 23 Дополнение 1: e12517. Дои:10.1111 / hel.12517. ЧВК 6310010. PMID 30277626.
внешняя ссылка
| Классификация |
|---|