WikiDer > Реакция Фриделя – Крафтса
| Реакция Фриделя-Крафтса | |
|---|---|
| Названный в честь | Чарльз Фридель Джеймс Крафтс |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| RSC ID онтологии | RXNO: 0000369 |
В Реакции Фриделя – Крафтса представляют собой набор реакции разработан Чарльз Фридель и Джеймс Крафтс в 1877 году для присоединения заместителей к ароматическое кольцо.[1] Реакции Фриделя – Крафтса бывают двух основных типов: алкилирование реакции и ацилирование реакции. Оба продолжаются электрофильное ароматическое замещение.[2][3][4][5]
Алкилирование Фриделя – Крафтса
| Алкилирование Фриделя-Крафтса | |
|---|---|
| Названный в честь | Чарльз Фридель Джеймс Крафтс |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | фридел-ремесло-алкилирование |
| RSC ID онтологии | RXNO: 0000046 |
Алкилирование по Фриделю – Крафтсу включает алкилирование ароматическое кольцо с алкилгалогенид используя сильный Кислота Льюиса, Такие как хлорид алюминия, хлорид железа, или другой MXп реагент, как катализатор.[6] Общий механизм высшее алкилгалогениды показаны ниже.[7]
Для первичных (и, возможно, вторичных) алкилгалогенидов, карбокатион-подобный комплекс с кислотой Льюиса, [R(+)--- (X --- MXп)(–)], скорее всего, будет задействован, а не свободный карбокатион.
Эта реакция имеет тот недостаток, что продукт более нуклеофильный чем реагент, потому что алкильные группы активаторы реакции Фриделя – Крафтса. Следовательно, может происходить сверхалкилирование. Стерическое препятствие можно использовать для ограничения числа алкилирования, как в т-бутилирование 1,4-диметоксибензола.[8]
Более того, реакция полезна только для первичных алкилгалогенидов во внутримолекулярном смысле, когда образуется 5- или 6-членное кольцо. Для межмолекулярного случая реакция ограничивается высшее алкилирующие агенты, некоторые вторичные алкилирующие агенты (те, для которых перегруппировка карбокатиона является вырожденной) или алкилирующие агенты, которые дают стабилизированные карбокатионы (например, бензильные или аллильные). В случае первичных алкилгалогенидов карбокатионоподобный комплекс (R(+)--- X --- Al(-)Cl3) пройдет карбокатион реакция перегруппировки почти исключительно с получением перегруппированного продукта, полученного из вторичного или третичного карбокатиона.[7]
Алкилирование не ограничивается алкилгалогенидами: реакции Фриделя – Крафтса возможны с любыми карбокатионный промежуточные, такие как производные от алкены и протонная кислота, Кислота Льюиса, Enones, и эпоксиды. Примером может служить синтез неофилхлорид из бензола и хлористого металлила:[9]
- ЧАС2C = C (CH3) CH2Cl + C6ЧАС6 → С6ЧАС5C (CH3)2CH2Cl
В одном исследовании электрофил - это ион бромония полученный из алкена и NBS:[10]
В этой реакции трифлат самария (III) Считается, что активирует донор галогена NBS при образовании иона галогена.
Деалкилирование Фриделя – Крафтса
Было выдвинуто предположение, что алкилирование Фриделя-Крафтса обратимый. В реакция ретро-Фриделя – Крафтса или же Деалкилирование Фриделя – Крафтса, алкильные группы удаляются в присутствии протонов или других Кислота Льюиса.
Например, при многократном добавлении этилбромид к бензол, орто и параграф замена ожидается после первой стадии монозамещения, потому что алкильная группа является активирующая группа. Однако реальный продукт реакции 1,3,5-триэтилбензол со всеми алкильными группами как мета заместитель.[11] Термодинамический контроль реакции гарантирует, что термодинамически благоприятный мета замена на стерическое препятствие преобладание минимизированных дублей над менее благоприятными орто и параграф замена на химическое равновесие. Таким образом, конечный продукт реакции является результатом серии алкилирования и деалкилирования.[12]
Ацилирование Фриделя – Крафтса
| Ацилирование Фриделя-Крафтса | |
|---|---|
| Названный в честь | Чарльз Фридель Джеймс Крафтс |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | фридел-ремесла-ацилирование |
| RSC ID онтологии | RXNO: 0000045 |
Ацилирование Фриделя – Крафтса включает ацилирование ароматических колец. Типичными ацилирующими агентами являются ацилхлориды. Типичный Кислота Льюиса катализаторами являются кислоты и трихлорид алюминия. Однако, поскольку кетон продукта образует довольно стабильный комплекс с кислотами Льюиса, такими как AlCl3, как правило, должно использоваться стехиометрическое количество или более «катализатора», в отличие от случая алкилирования Фриделя-Крафтса, при котором катализатор постоянно регенерируется. Ацилирование Фриделя – Крафтса также возможно с ангидриды кислот.[13] Условия реакции аналогичны алкилированию по Фриделю – Крафтсу. Эта реакция имеет несколько преимуществ по сравнению с реакцией алкилирования. Из-за электроноакцепторного эффекта карбонил группа, кетон продукт всегда менее реакционноспособен, чем исходная молекула, поэтому множественного ацилирования не происходит. Также нет карбокатион перестановки, как ион ацилия стабилизируется резонансной структурой, в которой положительный заряд находится на кислороде.
Жизнеспособность ацилирования Фриделя – Крафтса зависит от стабильности ацилхлоридного реагента. Например, формилхлорид слишком нестабилен, чтобы его можно было выделить. Таким образом, синтез бензальдегид через путь Фриделя-Крафтса требует, чтобы был синтезирован формилхлорид. на месте. Это достигается Реакция Гаттермана-Коха, достигнутая обработкой бензола с монооксид углерода и хлористый водород под высоким давлением, катализируемый смесью хлорид алюминия и хлорид меди.
Механизм реакции
Реакция протекает через образование ацилиевого центра. Реакция завершается депротонированием арений ион по AlCl4−, регенерируя AlCl3 катализатор. Однако, в отличие от настоящей реакции каталитического алкилирования, образующийся кетон представляет собой умеренное основание Льюиса, которое образует комплекс с сильным трихлоридом алюминия кислоты Льюиса. Образование этого комплекса обычно необратимо в условиях реакции. Таким образом, стехиометрическое количество AlCl3 необходим. Комплекс разрушается при водной обработке с получением желаемого кетона. Например, классический синтез дезоксибензоина требует 1,1 эквивалента AlCl3 что касается ограничивающего реагента, фенилацетилхлорида.[14] В некоторых случаях, как правило, когда бензольное кольцо активировано, ацилирование Фриделя-Крафтса также можно проводить с каталитический количества более мягкой кислоты Льюиса (например, солей Zn (II)) или кислотного катализатора Бренстеда с использованием ангидрида или даже самой карбоновой кислоты в качестве ацилирующего агента.
Если желательно, полученный кетон может быть впоследствии восстановлен до соответствующего алканового заместителя либо Редукция Вольфа – Кишнера или же Редукция Клемменсена. Конечный результат такой же, как и при алкилировании Фриделя-Крафтса, за исключением того, что перегруппировка невозможна.[15]
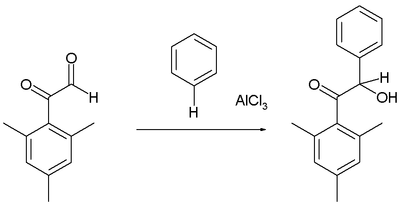
Гидроксиалкилирование Фриделя – Крафтса
Арены реагируют определенным альдегиды и кетоны с образованием гидроксиалкилированных продуктов, например, в реакции мезитил производная от глиоксаль с бензолом:[16]
Как обычно, альдегидная группа является более реактивной электрофильной группой, чем фенон.
Объем и варианты
Эта реакция связана с несколькими классическими реакциями:
- Ацилированный продукт реакции можно превратить в алкилированный продукт через Редукция Клемменсена.[17][18][19]
- В Реакция Гаттермана – Коха может быть использован для синтеза бензальдегида из бензола.[20]
- В Реакция Гаттермана описывает реакции аренов с синильной кислотой.[21]
- В Реакция Губена – Хёша описывает реакции аренов с нитрилами.[22][23]
- Модификация реакции с ароматическим фениловым эфиром в качестве реагента называется модификацией реакции. Перестановка фри.
- в Реакция Шолля две арены пара напрямую (иногда их называют Арилирование Фриделя – Крафтса).[24][25]
- в Реакция Зинке – Зуля п-крезол алкилируется до циклогексадиенона тетрахлорметаном.[26]
- в Блан хлорметилирование хлорметильную группу добавляют к арену с формальдегидом, соляной кислотой и хлоридом цинка.[27][28]
- В Синтез Богерта – Кука (1933) включает обезвоживание и изомеризация из 1-β-фенилэтилциклогексанол к октагидропроизводному фенантрен[29]
- В Синтез кетонов по Дарценсу – Неницеску. (1910, 1936) включает ацилирование циклогексен с ацетилхлорид к метилциклогексенилкетону.
- В связанных Восстановительное ацилирование по Неницеску (1936) а насыщенный углеводород добавлен, что делает его восстановительным ацилированием до метилциклогексилкетона
- В Реакция Ненцкого (1881) представляет собой ацетилирование фенолов кислотами в присутствии хлорида цинка.[30]
- В зеленая химия вариация хлорид алюминия заменяется на графит в алкилировании п-ксилол с 2-бромбутан. Этот вариант не работает с первичными галогенидами, из которых следует меньшее участие карбокатиона.[31]
Красители
Реакции Фриделя – Крафтса были использованы в синтезе нескольких триарилметан и ксантен красители.[32] Примеры - синтез тимолфталеин (индикатор pH) из двух эквивалентов тимол и фталевый ангидрид:
Реакция фталевого ангидрида с резорцин в присутствии хлорид цинка дает флуорофор флуоресцеин. Замена резорцина N, N-диэтиламинофенолом в этой реакции дает родамин B:
Реакции Хаворта
В Реакция Хаворта классический метод синтеза 1-тетралон.[33] В этой реакции бензол реагирует с янтарный ангидридпромежуточный продукт восстанавливается, и происходит второе ацилирование FC с добавлением кислоты.[34]
В соответствующей реакции фенантрен синтезируется из нафталин и янтарный ангидрид в серии стадий, которые начинаются с ацилирования FC.
Тест Фриделя – Крафтса для ароматических углеводородов
Реакция хлороформ с ароматическими соединениями с использованием хлорид алюминия катализатор дает триарилметаны, которые часто ярко окрашены, как в случае с триарилметановыми красителями. Это стендовый тест для ароматических соединений.[35]
Смотрите также
- Окись этилена
- Семья Фридель, богатая линия французских ученых
- Гидродеалкилирование
- Трансалкилирование
Рекомендации
- ^ Friedel, C .; Ремесла, Дж. М. (1877) "Sur une nouvelle méthode générale de synthèse d'hydrocarbures, d'acétones, и т. Д." Компт. Ренд., 84: 1392 & 1450.
- ^ Прайс, К. К. (1946). «Алкилирование ароматических соединений по методу Фриделя-Крафтса». Орг. Реагировать. 3: 1. Дои:10.1002 / 0471264180.or003.01. ISBN 0471264180.
- ^ Гровс, Дж. К. (1972). "Ацилирование алкенов по Фриделю-Крафтсу". Chem. Soc. Ред. 1: 73. Дои:10.1039 / cs9720100073.
- ^ Эйли, С. С. (1991). «Алифатическая реакция Фриделя – Крафтса». Компр. Орг. Синтезатор. 2: 707–731. Дои:10.1016 / B978-0-08-052349-1.00045-7. ISBN 978-0-08-052349-1.
- ^ Хини, Х. (1991). "Бимолекулярная ароматическая реакция Фриделя – Крафтса". Компр. Орг. Синтезатор. 2: 733–752. Дои:10.1016 / B978-0-08-052349-1.00046-9. ISBN 978-0-08-052349-1.
- ^ Rueping, M .; Нахтсхайм, Б. Дж. (2010). «Обзор новых разработок в алкилировании Фриделя – Крафтса - от зеленой химии до асимметричного катализа». Beilstein J. Org. Chem. 6 (6): 6. Дои:10.3762 / bjoc.6.6. ЧВК 2870981. PMID 20485588.
- ^ а б Смит, Майкл Б .; Марш, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Л., Уильямсон, Кеннет (4 января 2016 г.). Макромасштабные и микромасштабные органические эксперименты. Мастерс, Кэтрин М. (Седьмое изд.). Бостон, Массачусетс, США. ISBN 9781305577190. OCLC 915490547.
- ^ Smith, W. T. Jr .; Селлас, Дж. Т. (1963). «Неофилхлорид». Органический синтез.
- ^ Hajra, S .; Maji, B .; Бар, С. (2007). "Катализируемое трифлатом самария галоген-промотированное алкилирование Фриделя – Крафтса алкенами". Орг. Lett. 9 (15): 2783–2786. Дои:10.1021 / ol070813t. PMID 17585769.
- ^ Anslyn, E .; Уоллес, К. Дж .; Hanes, R .; Мори, Дж .; Kilway, K. V .; Сигел, Дж. (2005). «Получение 1,3,5-трис (аминометил) -2,4,6-триэтилбензола из двух универсальных 1,3,5-три (галогензамещенных) 2,4,6-триэтилбензольных производных». Синтез. 2005 (12): 2080–2083. Дои:10.1055 / с-2005-869963.
- ^ Норман, Ричард Освальд Чендлер; Коксон, Джеймс Моррис (1993). Принципы органического синтеза (3-е изд.). Лондон: Blackie Academic & Professional. ISBN 0751401269. OCLC 27813843.
- ^ Somerville, L.F .; Аллен, К. Ф. Х. (1933). «β-Бензоилпропионовая кислота». Органический синтез. 13: 12. Дои:10.15227 / orgsyn.013.0012.
- ^ «Дезоксибензоин». www.orgsyn.org. Получено 26 января 2019.
- ^ Ацилирование Friedel-Crafts. Organic-chemistry.org. Проверено 11 января 2014.
- ^ Fuson, R.C .; Weinstock, H.H .; Уллёт, Г. Э. (1935). «Новый синтез бензоинов. 2 ', 4', 6'-триметилбензоин». Варенье. Chem. Soc. 57 (10): 1803–1804. Дои:10.1021 / ja01313a015.
- ^ Клемменсен, Э. (1913). "Reduktion von Ketonen und Aldehyden zu den entsprechenden Kohlenwasserstoffen unter Anwendung von amalgamiertem Zink und Salzsäure". Chemische Berichte. 46 (2): 1837–1843. Дои:10.1002 / cber.19130460292.
- ^ Клемменсен, Э. (1914). "Uber eine allgemeine Methode zur Reduktion der Carbonylgruppe in Aldehyden und Ketonen zur Methylengruppe". Chemische Berichte. 47: 51–63. Дои:10.1002 / cber.19140470108.
- ^ Клемменсен, Э. (1914). "Uber eine allgemeine Methode zur Reduktion der Carbonylgruppe in Aldehyden und Ketonen zur Methylengruppe. (III. Mitteilung.)". Chemische Berichte. 47: 681–687. Дои:10.1002 / cber.191404701107.
- ^ Gattermann, L .; Кох, Дж. А. (1897). "Ароматический альдегид Eine Synthese". Бер. 30 (2): 1622–1624. Дои:10.1002 / cber.18970300288.
- ^ Л. Гаттерманн; В. Берхельманн (1898). "Синтезированный ароматический оксальдегид". Berichte der Deutschen Chemischen Gesellschaft. 31 (2): 1765–1769. Дои:10.1002 / cber.18980310281.
- ^ Hoesch, Курт (1915). "Eine neue Synthese aromatischer Ketone. I. Darstellung einiger Фенол-кетон". Berichte der Deutschen Chemischen Gesellschaft. 48 (1): 1122–1133. Дои:10.1002 / cber.191504801156.
- ^ Хубен, Дж. (1926). "Uber die Kern-Kondensation von Phenolen und Phenol-äthern mit Nitrilen zu Phenol- und Phenol-äther-Ketimiden und -Ketonen (I.)". Berichte der Deutschen Chemischen Gesellschaft (серии A и B). 59 (11): 2878–2891. Дои:10.1002 / cber.19260591135.
- ^ М. Б. Смит, Дж. Марч. Мартовская продвинутая органическая химия (Wiley, 2001) (ISBN 0-471-58589-0)
- ^ Grzybowski, M .; Skonieczny, K .; Butenschön, H .; Грыко, Д. Т. (2013). «Сравнение окислительного ароматического сочетания и реакции Шолля». Энгью. Chem. Int. Эд. 52 (38): 9900–9930. Дои:10.1002 / anie.201210238. PMID 23852649.
- ^ Zincke, Th.; Зуль. Р. (1906). "Ueber die Einwirkung von Tetrachlorkohlenstoff und Aluminiumchlorid auf п-Kresol und п-Kresolderivate ". Chemische Berichte. 39 (4): 4148–4153. Дои:10.1002 / cber.190603904115.
- ^ Блан, Гюстав Луи (1923). Бюллетень химического общества Франции [4]. 33: 313–319. Отсутствует или пусто
| название =(помощь) - ^ Дж. Грасси и К. Маселли (1898) "Su alcuni Derivati clorurati de trossimetilene" (О некоторых хлорированных производных 1,3,5-триоксана), Gazzetta Chimica Italiana, 28 (часть 2): 477-500; особенно см. стр. 495.
- ^ Эта реакция спятиокись фосфора: Kamp, J.V.D .; Мозеттиг, Э. (1936). «Транс- и цис-октагидрофенантрена». Журнал Американского химического общества. 58 (6): 1062–1063. Дои:10.1021 / ja01297a514.
- ^ Nencki, M .; Зибер, Н. (1881). "Ueber die Verbindungen der ein- und zweibasischen Fettsäuren mit Phenolen". J. Prakt. Chem. (на немецком). 23: 147–156. Дои:10.1002 / prac.18810230111.
- ^ Середа, Григорий А .; Раджпара, Викул Б. (2007). «Зеленая альтернатива алкилированию ксилола хлоридом алюминия». J. Chem. Educ. 2007 (84): 692. Bibcode:2007JChEd..84..692S. Дои:10.1021 / ed084p692.
- ^ McCullagh, Джеймс V .; Даггетт, Келли А. (2007). «Синтез триарилметановых и ксантеновых красителей с использованием реакций электрофильного ароматического замещения». J. Chem. Educ. 84 (11): 1799. Bibcode:2007JChEd..84,1799M. Дои:10.1021 / ed084p1799 (неактивно 22 ноября 2020 г.).CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
- ^ Хаворт, Роберт Даунс (1932). «Синтезы алкилфенантренов. Часть I. 1-, 2-, 3- и 4-метилфенантрены». J. Chem. Soc.: 1125. Дои:10.1039 / JR9320001125.
- ^ Ли, Джи Джек (2003) Назовите реакции: сборник подробных механизмов реакции, Спрингер, ISBN 3-540-40203-9, п. 175.
- ^ Джон С. Гилберт, Стивен Ф. Мартин. Brooks / Cole CENGAGE Learning, 2011. стр. 872. 25.10 Ароматические углеводороды и арилгалогениды - Классификационный тест. ISBN 978-1-4390-4914-3
Реакции Фриделя – Крафтса опубликованы на Органический синтез
Эта секция использует цитаты который ссылка на неработающие или устаревшие источники. (Январь 2019) (Узнайте, как и когда удалить этот шаблон сообщения) |
- Алкилирование:
- Дифенилацетон, Organic Syntheses, Coll. Vol. 3, стр. 343 (1955); Vol. 29, стр. 38 (1949) Ссылка на статью.
- Реакция п-ксилол с хлорметан к дюрен Organic Syntheses, Coll. Vol. 2, стр. 248 (1943); Vol. 10, стр. 32 (1930). Ссылка на статью
- Синтез бензофенон из бензол и тетрахлорметан Organic Syntheses, Coll. Vol. 1, стр. 95 (1941); Vol. 8, стр. 26 (1928 г.).Ссылка на статью
- Ациляции:
- Dibenzoylethylene Organic Syntheses, Coll. Vol. 3, стр. 248 (1955); Vol. 20, стр. 29 (1940) Ссылка на статью.
- реакция аценафтен плюс Янтарная кислота Organic Syntheses, Coll. Vol. 3, стр. 6 (1955); Vol. 20, стр. 1 (1940).Ссылка на статью
- Desoxybenzoin Organic Syntheses, Coll. Vol. 2, стр. 156 (1943); Vol. 12, стр. 16 (1932 г.). Ссылка на статью
- Ацилирование фенантрен соединение Organic Syntheses, Vol. 80, стр. 227 Связь
- Реакция бромбензол с уксусный ангидрид Organic Syntheses, Coll. Vol. 1, стр. 109 (1941); Vol. 5, стр. 17 (1925 г.). Ссылка на статью
- бета-метилантрахинон, Organic Syntheses, Coll. Vol. 1, стр. 353 (1941); Vol. 4, стр. 43 (1925 г.). Ссылка на статью
- Бензоилирование ферроцен Organic Syntheses, Coll. Vol. 6, стр. 625 (1988); Vol. 56, стр. 28 (1977). Ссылка на статью