WikiDer > Мопролол - Википедия
 | |
| Имена | |
|---|---|
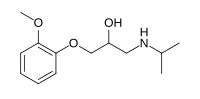
| Название ИЮПАК 1- (2-Метоксифенокси) -3- (пропан-2-иламино) пропан-2-ол | |
| Другие имена (±) -мопролол | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.024.777 |
| Номер ЕС |
|
| MeSH | C009976 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C13ЧАС21NО3 | |
| Молярная масса | 239.315 г · моль−1 |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Мопролол это бета-адренергический антагонист,[1] или же бета-блокатор. Обычно мопролол назначают для лечения гипертония, высокое кровяное давление, беспокойство, и глаукома[2]. Мопролол был впервые представлен SIMS, или S.p.A Societa Italiana Medicinali e Sintetici, в 1982 году. SIMS - это частная итальянская компания, работающая в фармацевтической промышленности с 1937 года. В 1972 году SIMS впервые представила Мастер-файл наркотиков в США FDA и продолжал делать это на протяжении многих лет.[3] В дополнение к составлению мопролола SIMES также производит Omeral и Levotensin, производные мопролола.
История регулирования
Мопролол занимал видное место как в литературе, так и в клинических испытаниях до 1990-х годов. В этот момент мопролол был снят с продажи. Это могло произойти по ряду причин, включая отзыв FDA и неэффективные составы. В ходе некоторых клинических испытаний выяснилось, что мопролол не так эффективен для лечения артериального давления, как первоначально предполагалось, и это будет рассмотрено в клиническом разделе.
Несмотря на то, что не было никаких конкретных отзывов мопролола FDA, FDA выпустило предупреждения для SIMS. В 2000 году FDA и Министерство здравоохранения и науки США выпустили предупредительное письмо в центр SIMS.[4] В этом письме говорится, что во время плановой проверки объекта SIMS были обнаружены значительные отклонения от требований США. хороший производственная практика при производстве активных фармацевтических ингредиентов. Затем SIMS была уведомлена о том, что до тех пор, пока эти отклонения не будут исправлены и не будет завершена еще одна инспекция FDA, FDA будет отклонять любые заявки на активные фармацевтические ингредиенты от объекта SIMS.
Затем в июне 2015 года FDA выпустило предупреждение об импорте, включая SIMS.[5] В этом предупреждении говорилось, что некоторые активные фармацевтические ингредиенты имели неправильную марку. Следовательно, в приеме любых активных фармацевтических ингредиентов может быть отказано, если учреждение, в котором они находятся, указано в этом предупреждении.
До того, как мопролол был снят с продажи, он отпускался по рецепту, то есть его должен был назначать врач и нельзя было отпускать без рецепта.
Клинические исследования
Мопролол был предметом многих клинических испытаний для изучения влияния мопролола как на артериальное давление, так и на глаукому.
Во многих исследованиях артериального давления и артериального давления мопролол назначают в таблетках один раз в день, обычно по графику. При исследованиях глаукомы мопролол обычно назначают в виде офтальмологического раствора, в который вводят ½ капли 1% раствора мопролола 2-3 раза в день.[6] Конкретные дозировки и концентрации могут варьироваться в зависимости от тяжести состояния.
В 2013 году было проведено одно значимое клиническое исследование гипертонии, в котором использовался неселективный бета-блокатор для изучения влияния на снижение артериального давления.[7] В этом исследовании 30 участникам давали 75 мг мопролола дважды в день. В ходе этого исследования было обнаружено, что мопролол не оказывает значительного влияния на снижение частоты сердечных сокращений.
Еще одно важное клиническое испытание по лечению глаукомы мопрололом было проведено в 1994 году.[1] Это было двойное слепое проспективное исследование для проверки эффективности снижения внутриглазного давления при использовании только l-мопролола и в комбинации с дипивефрином. В этом исследовании 27 пациентов с глаукомой или глазной гипертензией получали глазные капли с l-мопрололом дважды в день в течение 4 недель. После этого в течение еще 4 недель вводили комбинацию L-мопролола и дипивефрина. В ходе этого исследования было обнаружено, что l-мопролол является хорошим средством лечения глаукомы, но лечение, состоящее из комбинации препаратов от гипертонии, может иметь больший эффект при снижении глазного давления.
Оба исследования показывают, что мопролол или его производные в некоторой степени снижают кровяное давление, но могут не влиять на частоту сердечных сокращений. Это открывает путь для будущих исследований, особенно в области лечения глаукомы.
Коммерциализация
Мопролол был впервые запатентован SIMS в 1987 году под номером патента США 4647590.[8] В этом патенте ВИМС говорится, что мопролол можно использовать для лечения глаукомы при местном введении, а также для лечения артериальной гипертензии. Затем мы переходим к проведенным исследованиям, которые доказали эффективность мопролола для лечения этих состояний без побочных эффектов лечения, представленного на рынке. Это привело к появлению множества других патентов, некоторые из которых перечислены в таблице ниже:
| Дата регистрации | Дата публикации | Заявитель | Заголовок | |
|---|---|---|---|---|
| США 4683245[9] | 14 октября 1982 г. | 28 июля 1987 г. | SIMS | Левовращающий антипод мопролола как антигипертензивное средство |
| EP 0118940[10] | 9 февраля 1984 г. | 29 июля 1988 г. | SIMS | Использование L-мопролола для производства жидкой офтальмологической композиции для лечения глаукомы |
| США 20030060477[11] | 27 марта 2001 г. | 27 марта 2003 г. | Горан Фондджерс, Олов Виклунд, Джон Викстранд | Комбинация бета-блокатора и холестеринснижающего средства |
Как уже упоминалось ранее, мопролол в настоящее время отсутствует на рынке, скорее всего, из-за того, что установка SIMS нарушает надлежащую производственную практику США. Это означает, что в настоящее время мопролол не производит продаж.
При этом все еще существует огромный рынок мопролола для лечения гипертонии и глаукомы. Аналогичный бета-блокатор, метопролол, очень популярный как за рубежом, так и в США, в 2010 году принес в Европе около 2,2 миллиона евро.[12] Метопролол также продается по цене 2,93–0,76 доллара за таблетку здесь, в США.[13] Поскольку и мопролол, и метопролол лечат гипертонию, рынок и предполагаемые продажи должны быть одинаковыми, и все это является разумным для этого типа неинвазивного лечения.
Смотрите также
- Левомопролол, (S) -энантиомер мопролола
- Метопролол
Рекомендации
- ^ а б Россетти, L; Barbieri, P; Velati, P; Bujtar, E; Орзалези, Н. (1994). «Эффективность комбинации l-мопролола и дипивефрина в снижении внутриглазного давления при первичной открытоугольной глаукоме или при глазной гипертензии». Архив Клинической и экспериментальной офтальмологии Грефе = Albrecht von Graefes Archiv für klinische und Experimentelle Ophthalmologie. 232 (11): 670–4. PMID 7843592.
- ^ «База данных метаболома человека: метабокарта для мопролола (HMDB41935)». www.hmdb.ca. Получено 2015-11-30.
- ^ "Сториа СИМС Италия". www.simsitaly.it. Получено 2015-12-05.
- ^ Исследования, Центр оценки лекарственных средств и. «Предупреждающие письма и уведомления о письмах о нарушениях для фармацевтических компаний - Предупреждающие письма 2000 г.». www.fda.gov. Получено 2015-12-14.
- ^ «Уведомление об импорте 66–66». www.accessdata.fda.gov. Получено 2015-12-14.
- ^ «0118940 ИСПОЛЬЗОВАНИЕ L-МОПРОЛОЛА ДЛЯ ИЗГОТОВЛЕНИЯ ЖИДКОСТИ ОФТАЛЬМОЛОГИЧЕСКОГО СОСТАВА ДЛЯ ЛЕЧЕНИЯ ГЛАУКОМЫ». patentscope.wipo.int. Получено 2015-12-14.
- ^ Вонг, Гэвин В.К.; Райт, Джеймс М. Эффективность неселективных бета-адреноблокаторов при первичной гипертензии в отношении снижения артериального давления. Дои:10.1002 / 14651858.cd007452.pub2.
- ^ Фармацевтические композиции и их использование при лечении глаукомы, получено 2015-12-14
- ^ Левовращающий антипод мопролола как антигипертензивное средство, получено 2015-12-14
- ^ Использование L-мопролола для производства жидкой офтальмологической композиции для лечения глаукомы, получено 2015-12-14
- ^ Комбинация бета-блокатора и холестеринснижающего средства, получено 2015-12-14
- ^ «Годовой отчет 2010» (PDF). Recordati. Recordati S.p.A.
- ^ «Покупайте самые дешевые предложения». plusvision.eu. Получено 2015-12-14.