WikiDer > Фармацевтическая индустрия

В фармацевтическая индустрия открывает, разрабатывает, производит и продает наркотики или фармацевтические препараты для использования в качестве лекарства быть введенным (или самостоятельно) пациенты, с целью излечивать их, вакцинировать их, или облегчить симптомы.[1][2] Фармацевтические компании может иметь дело с общий или же марка лекарства и медицинские приборы. Они подлежат разнообразие законов и правила, регулирующие патентование, тестирование, безопасность, эффективность и маркетинг лекарств.
История
Середина 1800-х - 1945 гг .: от растений до первых синтетических наркотиков
Современная фармацевтическая промышленность началась с местных аптекарей, которые расширили свою традиционную роль в распространении растительных препаратов, таких как морфий и хинин к оптовому производству в середине 1800-х годов и к открытиям, сделанным в результате прикладных исследований. Преднамеренный открытие лекарств из растений началась с выделения между 1803 и 1805 годами морфий - обезболивающее и снотворное - из опиума от немецкого аптекаря Фридрих Сертюрнер, который назвал это соединение в честь греческого бога снов, Морфеус.[3] К концу 1880-х годов немецкие производители красителей усовершенствовали очистку индивидуальной органические соединения из смолы и других минеральных источников, а также разработали рудиментарные методы в органический химический синтез.[4] Развитие синтетических химических методов позволило ученым систематически изменять структуру химических веществ, и развитие новой науки о фармакология расширили свои возможности по оценке биологических эффектов этих структурных изменений.
Адреналин, норэпинефрин и амфетамин
К 1890-м годам глубокое влияние надпочечник были обнаружены экстракты многих различных типов тканей, что положило начало поискам как механизма передачи химических сигналов, так и попыткам использовать эти наблюдения для разработки новых лекарств. Повышение артериального давления и сосудосуживающие эффекты экстрактов надпочечников представляли особый интерес для хирургов, поскольку кровоостанавливающий агентов и для лечения шока, а ряд компаний разработали продукты на основе экстрактов надпочечников, содержащие активные вещества различной чистоты. В 1897 г. Джон Абель из Университет Джона Хопкинса идентифицировал активный принцип как адреналин, который он выделил в нечистом состоянии в виде сульфатной соли. Промышленный химик Дзёкичи Такамине позже разработал метод получения адреналина в чистом виде и лицензировал технологию для Парк-Дэвис. Компания Parke-Davis продавала адреналин под торговым наименованием. Адреналин. Адреналин в инъекциях оказался особенно эффективным при лечении острых заболеваний. астма атак, а ингаляционная версия продавалась в США до 2011 г. (Primatene Mist).[5][6] К 1929 году адреналин был разработан в виде ингалятора для лечения заложенности носа.
Несмотря на высокую эффективность, необходимость в инъекции ограничивала использование адреналина.[требуется разъяснение] и были осуществлены поиски орально активных производных. Структурно похожее соединение, эфедрин, (на самом деле больше похоже на норэпинефрин,) был идентифицирован японскими химиками в Ма Хуанг растение и продается компанией Eli Lilly как пероральное средство от астмы. Следуя работе Генри Дейла и Джорджа Баргера из Burroughs-Wellcome, академический химик Гордон Аллес синтезировал амфетамин и испытал его на пациентах с астмой в 1929 году. Доказано, что препарат оказывает лишь умеренное противоастматическое действие, но вызывает ощущение возбуждения и сердцебиения. Амфетамин был разработан Смит, Клайн и Френч как назальное противозастойное средство под торговой маркой Бензедрин ингалятор. Амфетамин в конечном итоге был разработан для лечения нарколепсия, постэнцефалитный паркинсонизми повышение настроения при депрессии и других психиатрических показаниях. Он получил одобрение в качестве нового и неофициального средства правовой защиты от Американская медицинская ассоциация для этих целей в 1937 г.[7] и оставались обычным средством от депрессии до тех пор, пока не развились трициклические антидепрессанты в 1960-е гг.[6]
Открытие и разработка барбитуратов
В 1903 г. Герман Эмиль Фишер и Йозеф фон Меринг раскрыли свое открытие, что диэтилбарбитуровая кислота, образующаяся в результате реакции диэтилмалоновой кислоты, оксихлорида фосфора и мочевины, вызывает сон у собак. Открытие было запатентовано и лицензировано Байер Фармацевтика, которая продавала соединение под торговой маркой Веронал в качестве снотворного, начиная с 1904 г. Систематические исследования влияния структурных изменений на потенцию и продолжительность действия привели к открытию фенобарбитал в компании Bayer в 1911 году и открытие его мощного противоэпилептического действия в 1912 году. Фенобарбитал был одним из наиболее широко используемых препаратов для лечения эпилепсия в течение 1970-х годов и по состоянию на 2014 год остается в списке основных лекарств Всемирной организации здравоохранения.[8][9] В 1950-е и 1960-е годы возросло понимание способности барбитуратов и амфетаминов вызывать привыкание и возможности злоупотребления, что привело к усилению ограничений на их использование и усилению государственного контроля над лицами, назначающими лекарства. Сегодня амфетамин в основном используется для лечения синдром дефицита внимания и фенобарбитал при лечении эпилепсия.[10][11]
Инсулин
Серия экспериментов, проведенных с конца 1800-х до начала 1900-х годов, показала, что сахарный диабет вызвано отсутствием вещества, которое обычно вырабатывается поджелудочной железой. В 1869 г. Оскар Минковски и Йозеф фон Меринг обнаружили, что диабет у собак может быть вызван хирургическим удалением поджелудочной железы. В 1921 году канадский профессор Фредерик Бантинг и его ученик Чарльз Бест повторили это исследование и обнаружили, что инъекции экстракта поджелудочной железы обращают вспять симптомы, вызванные удалением поджелудочной железы. Вскоре было продемонстрировано, что экстракт работает на людях, но развитие инсулиновой терапии как рутинной медицинской процедуры было отложено из-за трудностей с получением материала в достаточном количестве и с воспроизводимой чистотой. Исследователи обратились за помощью к промышленным сотрудникам Eli Lilly and Co., основываясь на опыте компании в крупномасштабной очистке биологических материалов. Химик Джордж Б. Уолден из Eli Lilly and Company обнаружили, что тщательная регулировка pH экстракта позволяет производить относительно чистый сорт инсулина. Под давлением Университета Торонто и потенциальным патентным вызовом со стороны академических ученых, которые независимо разработали аналогичный метод очистки, было достигнуто соглашение о неисключительном производстве инсулина несколькими компаниями. До открытия и широкого распространения инсулиновой терапии продолжительность жизни диабетиков составляла всего несколько месяцев.[12]
Ранние антиинфекционные исследования: сальварсан, пронтозил, пенициллин и вакцины
Разработка лекарств для лечения инфекционных заболеваний была основным направлением ранних исследований и разработок; в 1900 году пневмония, туберкулез и диарея были тремя основными причинами смерти в Соединенных Штатах, а смертность в первый год жизни превышала 10%.[13][14]
В 1911 г. арсфенамин, первый синтетический противоинфекционный препарат, был разработан Пол Эрлих и химик Альфред Бертхайм из Института экспериментальной терапии в Берлине. Препарат получил коммерческое название Сальварсан.[15] Эрлиха, отмечая как общую токсичность мышьяк и селективное поглощение определенных красителей бактериями, выдвинули гипотезу о том, что краситель, содержащий мышьяк с аналогичными свойствами избирательного поглощения, может быть использован для лечения бактериальных инфекций. Арсфенамин был приготовлен в рамках кампании по синтезу ряда таких соединений, и было обнаружено, что он проявляет частично избирательную токсичность. Арсфенамин оказался первым эффективным средством от сифилисболезнь, которая до того времени была неизлечимой и неумолимо приводила к серьезным кожным изъязвлениям, неврологическим повреждениям и смерти.[16]
Подход Эрлиха к систематическому изменению химической структуры синтетических соединений и измерению воздействия этих изменений на биологическую активность широко применялся учеными-промышленниками, в том числе Байер ученые Йозеф Кларер, Фриц Мицш и Герхард Домагк. Эта работа, также основанная на тестировании соединений, доступных в немецкой красильной промышленности, привела к разработке Пронтозил, первый представитель сульфонамид класс антибиотики. По сравнению с арсфенамином, сульфаниламиды обладали более широким спектром активности и были гораздо менее токсичными, что делало их полезными при инфекциях, вызванных патогенами, такими как стрептококки.[17] В 1939 году Домагк получил Нобелевская премия по медицине за это открытие.[18][19] Тем не менее, резкое снижение смертности от инфекционных заболеваний, имевшее место до Вторая Мировая Война в первую очередь был результатом улучшенных мер общественного здравоохранения, таких как чистая вода и менее тесное жилье, а воздействие противоинфекционных препаратов и вакцин было значительным в основном после Второй мировой войны.[20][21]
В 1928 г. Александр Флеминг обнаружил антибактериальные эффекты пенициллин, но его использование для лечения болезней человека требовало разработки методов его крупномасштабного производства и очистки. Они были разработаны консорциумом фармацевтических компаний под руководством правительства США и Великобритании во время Второй мировой войны.[22]
Ранний прогресс в разработке вакцин произошел в течение этого периода, в основном в форме академических и финансируемых государством фундаментальных исследований, направленных на выявление патогенов, ответственных за распространенные инфекционные заболевания. В 1885 г. Луи Пастер и Пьер Поль Эмиль Ру создал первый вакцина против бешенства. Первый вакцины против дифтерии были произведены в 1914 году из смеси дифтерийный токсин и антитоксин (полученный из сыворотки привитого животного), но безопасность прививки была минимальной, и он не получил широкого распространения. В 1921 году в Соединенных Штатах было зарегистрировано 206 000 случаев дифтерии, в результате которых погибло 15 520 человек. В 1923 году параллельные усилия Гастон Рамон в Институте Пастера и Александр Гленни в исследовательских лабораториях Wellcome (позже часть GlaxoSmithKline) привел к открытию того, что более безопасную вакцину можно производить, обрабатывая дифтерийный токсин формальдегид.[23] В 1944 г. Морис Хиллеман компании Squibb Pharmaceuticals разработала первую вакцина против японского энцефелита.[24] Хиллеман позже переехал в Merck где он будет играть ключевую роль в разработке вакцин против корь, свинка, ветряная оспа, краснуха, гепатит А, гепатит Б, и менингит.
Небезопасные лекарства и раннее регулирование отрасли

До 20 века лекарства, как правило, производились небольшими производителями, которые практически не контролировали производство или не заявляли о безопасности и эффективности. Поскольку такие законы действительно существовали, их исполнение было слабым. В Соединенных Штатах усиление регулирования вакцин и других биологических препаратов было вызвано вспышками столбняка и смертями, вызванными распространением зараженной противооспенной вакцины и дифтерийного антитоксина.[25] Закон о контроле за биологическими препаратами 1902 года требовал, чтобы федеральное правительство выдавало предпродажное разрешение на каждое биологическое лекарство, а также на процесс и установку, производящую такие лекарства. Затем в 1906 г. Закон о чистых пищевых продуктах и лекарствах, который запрещал межгосударственное распространение фальсифицированных продуктов и лекарств или лекарств с неправильным брендом. Наркотик считался недействительным, если он содержал алкоголь, морфин, опиум, кокаин или некоторые другие потенциально опасные наркотики или наркотики, вызывающие привыкание, и если на его этикетке не было указано количество или пропорция таких наркотиков. Попытки правительства использовать закон для преследования производителей за необоснованные заявления об эффективности были подорваны постановлением Верховного суда, ограничивающим правоприменительные полномочия федерального правительства случаями неправильной спецификации ингредиентов препарата.[26]
В 1937 году более 100 человек умерли от приема пищи "Эликсир сульфаниламид"производства S.E. Massengill Company, Теннесси. Продукт был разработан в диэтиленгликоль гликоль, высокотоксичный растворитель, который сейчас широко используется в качестве антифриза.[27] Согласно действовавшим в то время законам, судебное преследование производителя было возможно только при условии, что продукт назывался «эликсиром», что буквально означало раствор в этаноле. В ответ на этот эпизод Конгресс США принял Федеральный закон о пищевых продуктах, лекарствах и косметических средствах 1938 г., что впервые потребовало предпродажной демонстрации безопасности перед тем, как лекарство может быть продано, и прямо запретило ложные терапевтические утверждения.[28]
Послевоенные годы 1945–1970 гг.
Дальнейшие достижения в области антиинфекционных исследований
Последствия Вторая Мировая Война увидел взрыв в открытии новых классов антибактериальных препаратов[29] в том числе цефалоспорины (разработан Eli Lilly на основе плодотворной работы Джузеппе Бротцу и Эдвард Абрахам),[30][31] стрептомицин (обнаружено в ходе исследовательской программы, финансируемой Merck, в лаборатории Селмана Ваксмана.[32]) тетрациклины[33] (обнаружено в Lederle Laboratories, ныне являющейся частью Pfizer), эритромицин (обнаружен в Eli Lilly and Co.)[34] и их распространение на все более широкий спектр бактериальных патогенов. Стрептомицин, обнаруженный в ходе исследовательской программы, финансируемой компанией Merck, в лаборатории Селмана Ваксмана в Рутгерсе в 1943 году, стал первым эффективным лекарством от туберкулеза. На момент открытия санатории для изоляции больных туберкулезом были обычным явлением в городах развитых стран, и 50% из них умирали в течение 5 лет после поступления.[32][35]
В отчете Федеральной торговой комиссии, опубликованном в 1958 году, сделана попытка количественно оценить влияние разработки антибиотиков на здоровье населения США. В отчете установлено, что за период 1946–1955 гг. Произошло снижение на 42% случаев заболеваний, при которых антибиотики были эффективны, и только на 20% - для тех, при которых антибиотики были неэффективны. В отчете сделан вывод, что «похоже, что использование антибиотиков, ранняя диагностика и другие факторы ограничили распространение эпидемии и, следовательно, количество этих заболеваний». В исследовании дополнительно изучались уровни смертности от восьми распространенных заболеваний, для которых антибиотики предлагали эффективную терапию (сифилис, туберкулез, дизентерия, скарлатина, коклюш, менингококковые инфекции и пневмония), и было обнаружено снижение на 56% за тот же период.[36] Среди них следует отметить снижение смертности от туберкулеза на 75%.[37]
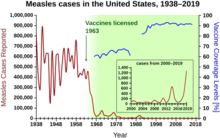
В 1940–1955 годах темпы спада в США смертность ускорился с 2% в год до 8% в год, затем вернулся к исторической ставке 2% в год. Резкий спад в первые послевоенные годы был приписан быстрой разработке новых методов лечения и вакцин от инфекционных заболеваний, которые произошли в эти годы.[20][21]Разработка вакцин продолжала ускоряться, при этом самым заметным достижением этого периода было Йонас СолкРазработка вакцины против полиомиелита в 1954 году при финансировании некоммерческого Национального фонда детского паралича. Процесс создания вакцины никогда не был запатентован, а вместо этого был предоставлен фармацевтическим компаниям для производства как недорогой вариант. общий. В 1960 году Морис Хиллеман из Merck Sharp & Dohme определил SV40 вирус, который, как позже было показано, вызывает опухоли у многих видов млекопитающих. Позже было установлено, что SV40 присутствовал в качестве контаминанта в партиях вакцины против полиомиелита, которую вводили 90% детей в Соединенных Штатах.[38][39] Загрязнение, по-видимому, произошло как из исходного клеточного материала, так и из ткани обезьяны, используемой для производства. В 2004 году Институт рака США объявил, что пришел к выводу, что SV40 не связан с раком у людей.[40]
Другие известные новые вакцины того периода включают вакцины от кори (1962, Джон Франклин Эндерс из Детского медицинского центра Бостона, позже усовершенствованные Морисом Хиллеманом из Merck), краснухи (1969, Hilleman, Merck) и эпидемического паротита (1967, Hilleman, Merck).[41] Заболеваемость краснухой, синдромом врожденной краснухи, корью и эпидемическим паротитом в Соединенных Штатах упала более чем на 95% сразу после широкомасштабной вакцинации.[42] Первые 20 лет лицензионного вакцинация против кори в США предотвращено примерно 52 миллиона случаев заболевания, 17 400 случаев умственная отсталостьи 5200 смертей.[43]
Разработка и маркетинг гипотензивных препаратов
Гипертония - фактор риска атеросклероза,[44] сердечная недостаточность,[45] ишемическая болезнь сердца,[46][47] Инсульт,[48] почечная болезнь,[49][50] и заболевание периферических артерий,[51][52] и это самое главное фактор риска за сердечно-сосудистый болезненность и смертность, в промышленно развитые страны.[53] До 1940 года примерно 23% всех смертей среди людей старше 50 были связаны с гипертонией. В тяжелых случаях гипертонии лечили хирургическим путем.[54]
Ранние разработки в области лечения гипертонии включали блокаторы симпатической нервной системы ионом четвертичного аммония, но эти соединения никогда не использовались широко из-за их серьезных побочных эффектов, поскольку долгосрочные последствия высокого кровяного давления для здоровья еще не были установлены, и потому что их нужно было вводить путем инъекции.
В 1952 году исследователи из Ciba открыли первый доступный для приема внутрь сосудорасширяющий препарат - гидралазин.[55] Основным недостатком монотерапии гидралазином была потеря эффективности со временем (тахифилаксия). В середине 1950-х годов Карл Х. Бейер, Джеймс М. Спрэг, Джон Э. Бэр и Фредерик К. Новелло из Мерк и Ко. обнаружил и разработал хлоротиазид, который на сегодняшний день остается наиболее широко используемым гипотензивным препаратом.[56] Это развитие было связано со значительным снижением уровня смертности среди людей с гипертонией.[57] Изобретатели были отмечены Министерством здравоохранения. Премия Ласкера в 1975 году за «спасение бесчисленных тысяч жизней и облегчение страданий миллионов жертв гипертонии».[58]
Кокрановский обзор 2009 г. пришел к выводу, что тиазидные гипотензивные препараты снижают риск смерти (RR 0,89), инсульта (ОР 0,63), ишемической болезни сердца (ОР 0,84) и сердечно-сосудистых событий (ОР 0,70) у людей с высоким кровяным давлением.[59] В последующие годы были разработаны и нашли широкое применение в комбинированной терапии другие классы гипотензивных препаратов, включая петлевые диуретики (Лазикс / фуросемид, Hoechst Pharmaceuticals, 1963),[60] бета-блокаторы (ICI Pharmaceuticals, 1964)[61] Ингибиторы АПФ, и блокаторы рецепторов ангиотензина. Ингибиторы АПФ снижают риск нового начала заболевания почек [ОР 0,71] и смерти [ОР 0,84] у пациентов с диабетом, независимо от того, есть ли у них артериальная гипертензия.[62]
Оральные контрацептивы
До Второй мировой войны контроль рождаемости был запрещен во многих странах, а в Соединенных Штатах даже обсуждение методов контрацепции иногда приводило к судебному преследованию в соответствии с законом. Законы Комстока. Таким образом, история разработки оральных контрацептивов тесно связана с движение контроля рождаемости и усилиями активистов Маргарет Сэнгер, Мэри Деннетт, и Эмма Гольдман. На основе фундаментальных исследований, выполненных Грегори Пинкус и синтетические методы для прогестерона, разработанные Карл Джерасси в Syntex и по Фрэнк Колтон в G.D. Searle & Co., первый оральный контрацептив, Эновид, был разработан E.D. Searle and Co. и одобрено Управлением по контролю за продуктами и лекарствами в 1960 году. Первоначальный состав содержал чрезмерно чрезмерные дозы гормонов и вызывал серьезные побочные эффекты. Тем не менее, к 1962 году 1,2 миллиона американских женщин принимали противозачаточные таблетки, а к 1965 году их число увеличилось до 6,5 миллионов.[63][64][65][66] Доступность удобной формы временных противозачаточных средств привела к кардинальным изменениям в социальных обычаях, включая расширение диапазона вариантов образа жизни, доступных женщинам, уменьшение зависимости женщин от мужчин в применении противозачаточных средств, поощрение откладывания брака и увеличение числа добрачных отношений. -обитание.[67]
Талидомид и поправки Кефовера-Харриса
В США толчок к пересмотру Закона о FD&C явился результатом слушаний в Конгрессе, проведенных сенатором. Эстес Кефовер Теннесси в 1959 году. Слушания охватили широкий круг вопросов политики, включая злоупотребления рекламой, сомнительную эффективность лекарств и необходимость более строгого регулирования отрасли. В то время как импульс к принятию нового законодательства временно не стал предметом расширенных дебатов, возникла новая трагедия, которая подчеркнула необходимость более всеобъемлющего регулирования и послужила движущей силой для принятия новых законов.
12 сентября 1960 г. американский лицензиат, компания William S. Merrell из Цинциннати, подала заявку на новый препарат для препарата Кевадон (талидомид), седативное средство, которое продавалось в Европе с 1956 года. Медицинский сотрудник FDA, отвечающий за анализ этого соединения, Фрэнсис Келси, считает, что данные, подтверждающие безопасность талидомида, являются неполными. Фирма продолжала оказывать давление на Келси и FDA, чтобы они одобрили заявку до ноября 1961 года, когда препарат был снят с немецкого рынка из-за его связи с серьезными врожденными аномалиями. Несколько тысяч новорожденных в Европе и других странах пострадали от тератогенный эффекты талидомида. Без одобрения FDA фирма распространила Кевадон среди более чем 1000 врачей под предлогом использования в исследовательских целях. В ходе этого «исследования» более 20 000 американцев получали талидомид, в том числе 624 беременных пациентки, и около 17 известных новорожденных пострадали от воздействия препарата.[нужна цитата]
В талидомид трагедия воскресила законопроект Кефовера об усилении регулирования наркотиков, который застопорился в Конгрессе, и Поправка Кефовера-Харриса вступил в силу 10 октября 1962 года. Отныне производители должны были доказывать FDA, что их лекарства были эффективными и безопасными, прежде чем они могли поступить на рынок США. FDA получило полномочия регулировать рекламу рецептурных лекарств и устанавливать хорошая производственная практика. Закон требовал, чтобы все препараты, введенные в период с 1938 по 1962 год, были эффективными. Совместное исследование FDA и Национальной академии наук показало, что почти 40 процентов этих продуктов неэффективны. Десять лет спустя было начато столь же всестороннее исследование отпускаемых без рецепта продуктов.[68]
1970–1980-е годы
Статины
В 1971 году Акира Эндо, японский биохимик, работающий в фармацевтической компании Sankyo, идентифицировал мевастатин (ML-236B), молекулу, вырабатываемую грибом Penicillium citrinum, в качестве ингибитора HMG-CoA редуктазы, критического фермента, используемого организмом для производят холестерин. Испытания на животных показал очень хороший ингибирующий эффект как в клинические испытанияОднако долгосрочное исследование на собаках выявило токсические эффекты при более высоких дозах, и в результате мевастатин считался слишком токсичным для использования человеком. Мевастатин никогда не продавался из-за его побочных эффектов в виде опухолей, разрушения мышц, а иногда и смерти лабораторных собак.
П. Рой Вагелос, главный научный сотрудник, а затем генеральный директор Merck & Co, заинтересовался и совершил несколько поездок в Японию, начиная с 1975 года. К 1978 году Merck изолировал ловастатин (мевинолин, MK803) от грибка Aspergillus terreus, впервые поступил на рынок в 1987 году как Mevacor.[69][70][71]
В апреле 1994 г. результаты спонсируемого компанией Merck исследования показали, что Скандинавское исследование выживания симвастатина, были объявлены. Исследователи протестировали симвастатин, позже проданный Merck как Zocor, для 4444 пациентов с высоким уровнем холестерина и сердечными заболеваниями. По прошествии пяти лет исследование пришло к выводу, что у пациентов наблюдалось снижение уровня холестерина на 35%, и их шансы умереть от сердечного приступа снизились на 42%.[72] В 1995 году Zocor и Mevacor заработали Merck более 1 миллиарда долларов США. Эндо был награжден премией 2006 г. Премия Японии, а Премия Ласкера-Дебейки за клинические медицинские исследования в 2008 году. За «новаторское исследование нового класса молекул» для «снижения холестерина»[часть предложения][73][74]
Исследования и разработки
Открытие наркотиков это процесс, посредством которого потенциальные наркотики открыты или разработаны. В прошлом большинство лекарств было открыто либо путем выделения активного ингредиента из традиционных средств, либо путем счастливый открытие. Современное биотехнология часто фокусируется на понимании метаболические пути относящийся к болезнь состояние или возбудитель, и манипулируя этими путями, используя молекулярная биология или же биохимия. Многочисленные открытия новых лекарств традиционно выполнялись университетами и исследовательскими институтами.
Разработка лекарств относится к действиям, предпринимаемым после того, как соединение идентифицировано как потенциальное лекарство, чтобы установить его пригодность в качестве лекарства. Цели разработки лекарств - определение подходящих формулировка и дозирование, а также установить безопасность. Исследования в этих областях обычно включают в себя сочетание in vitro исследования in vivo исследования, и клинические испытания. Стоимость разработки на поздней стадии означала, что ее обычно проводят более крупные фармацевтические компании.[75]
Часто крупные транснациональные корпорации выставляют вертикальная интеграция, участвуя в широком спектре открытий и разработок лекарств, производства и контроля качества, маркетинга, продаж и распределения. С другой стороны, более мелкие организации часто сосредотачиваются на определенном аспекте, таком как обнаружение кандидатов в лекарства или разработка рецептур. Часто соглашения о сотрудничестве между исследовательскими организациями и крупными фармацевтическими компаниями заключаются для изучения потенциала новых лекарственных субстанций. В последнее время транснациональные компании все больше полагаются на контрактные исследовательские организации для управления разработкой лекарств.[76]
Стоимость инноваций
Препарат, средство, медикамент открытие и разработка очень дороги; из всех соединений, исследованных для использования на людях, только небольшая часть в конечном итоге одобренный в большинстве стран назначенными правительством медицинскими учреждениями или советами, которые должны утверждать новые наркотики прежде, чем они появятся на рынке в этих странах. В 2010 году было одобрено 18 NME (новых молекулярных объектов) и три биопрепараты от FDA, или 21 в общей сложности, что ниже 26 в 2009 году и 24 в 2008 году. С другой стороны, всего было всего 18 разрешений в 2007 году и 22 в 2006 году. С 2001 года Центр оценки лекарственных средств и Исследования получают в среднем 22,9 одобрения в год.[77]Это одобрение приходит только после значительных инвестиций в доклиническая разработка и клинические испытания, а также приверженность постоянному мониторинг безопасности. Лекарства, которые не проходят через этот процесс, часто влекут за собой большие затраты, но не приносят взамен никакой прибыли. Если принять во внимание стоимость этих неудачных лекарств, стоимость разработки нового успешного лекарства (новое химическое соединение, или NCE) оценивается примерно в 1,3 миллиарда долларов США.[78] (не включая маркетинговые расходы). Однако в 2012 году профессора Лайт и Лексчин сообщили, что уровень одобрения новых лекарств был относительно стабильным в среднем от 15 до 25 на протяжении десятилетий.[79]
В 2009 году отраслевые исследования и инвестиции достигли рекордного уровня в 65,3 миллиарда долларов.[80] В то время как стоимость исследований в США в период с 1995 по 2010 год составляла около 34,2 миллиарда долларов, доходы росли быстрее (выручка за это время выросла на 200,4 миллиарда долларов).[79]
Исследование консалтинговой фирмы Bain & Company сообщил, что затраты на открытие, разработку и запуск (с учетом маркетинговых и других коммерческих расходов) нового препарата (вместе с перспективными лекарствами, которые не работают) выросли за пятилетний период почти до 1,7 миллиарда долларов в 2003 году.[81] По данным Forbes, к 2010 году затраты на разработку составили от 4 до 11 миллиардов долларов на одно лекарство.[82]
Некоторые из этих оценок также учитывают альтернативные стоимость инвестирования капитала за много лет до реализации доходов (см. Временная стоимость денег). Из-за очень долгого времени, необходимого для открытия, разработки и утверждения фармацевтических препаратов, эти затраты могут составлять почти половину общих расходов. Прямым следствием цепочки создания добавленной стоимости фармацевтической промышленности является то, что крупные транснациональные фармацевтические корпорации склонны все больше отдавать на аутсорсинг риски, связанные с фундаментальными исследованиями, что в некоторой степени меняет отраслевую экосистему, поскольку биотехнологические компании играют все более важную роль, а общие стратегии меняются соответствующим образом.[83] Некоторые одобренные препараты, например, основанные на переработке существующих активный компонент (также называемые расширениями линий) намного дешевле в разработке.
Утверждение продукта
В Соединенных Штатах новые фармацевтические продукты должны быть одобрены Управление по контролю за продуктами и лекарствами (FDA) как безопасный и эффективный. Этот процесс обычно включает подачу Новый исследуемый препарат представление достаточных доклинических данных для продолжения испытаний на людях. После утверждения IND могут быть проведены три фазы постепенно увеличивающихся клинических испытаний на людях. Фаза I в основном изучает токсичность используя здоровых добровольцев. Фаза II может включать фармакокинетика и дозирование у пациентов, и Фаза III представляет собой очень большое исследование эффективности в целевой популяции пациентов. После успешного завершения фазы III тестирования, Заявка на новый препарат представлен в FDA. FDA рассматривает данные, и если продукт считается имеющим положительную оценку пользы и риска, выдается разрешение на продажу продукта в США.[84]
Четвертая фаза наблюдения после утверждения препарата также часто требуется из-за того, что даже самые крупные клинические испытания не могут эффективно предсказать распространенность редких побочных эффектов. Постмаркетинговое наблюдение обеспечивает тщательное наблюдение за безопасностью лекарственного средства после его выхода на рынок. В некоторых случаях может потребоваться ограничить показания к определенным группам пациентов, а в других субстанция полностью исключена с рынка.
FDA предоставляет информацию об одобренных лекарствах на сайте Orange Book.[85]
В Великобритании Агентство по регулированию лекарственных средств и товаров медицинского назначения утверждает и оценивает препараты для использования. Обычно утверждение в Великобритании и других европейских странах происходит позже, чем в США. Тогда это Национальный институт здравоохранения и передового опыта (NICE), для Англии и Уэльса, кто решает, если и как Национальный центр здоровья (NHS) разрешит (в смысле оплаты) их использование. В Британский национальный формуляр является основным руководством для фармацевтов и врачей.
Во многих западных странах за пределами США «четвертое препятствие» анализ экономической эффективности была разработана до того, как появились новые технологии. При этом основное внимание уделяется «цене эффективности» (например, с точки зрения затрат на QALY) рассматриваемых технологий. В Англии и Уэльсе NICE решает, будут ли лекарства и технологии доступны в NHS и при каких обстоятельствах, в то время как аналогичные договоренности существуют с Консорциум шотландских лекарств в Шотландии, а Консультативный комитет по фармацевтическим льготам в Австралии. Если продукт должен быть одобрен, он должен преодолеть порог рентабельности. Лечение должно отражать «соотношение цены и качества» и приносить чистую пользу обществу.
Орфанные препараты
Есть особые правила для некоторых редких заболеваний ("орфанных болезней") в нескольких крупных регулирующих территориях лекарственных средств. Например, заболевания, затрагивающие менее 200 000 пациентов в Соединенных Штатах или более крупные группы населения при определенных обстоятельствах, подпадают под действие Закона о лекарствах для сирот.[86] Поскольку медицинские исследования и разработка лекарств для лечения таких заболеваний невыгодны с финансовой точки зрения, компании, которые поступают таким образом, вознаграждаются снижением налогов, освобождением от платы и эксклюзивностью на рынке этого лекарства в течение ограниченного времени (семь лет), независимо от того, защищено ли лекарство. патентами.
Глобальные продажи
| Компания | Продажа фармацевтики (млн долларов) |
|---|---|
| Pfizer | 45,083 |
| GlaxoSmithKline | 40,156 |
| Санофи-Авентис | 38,555 |
| Рош | 27,290 |
| АстраЗенека | 26,475 |
| Джонсон и Джонсон | 23,267 |
| Новартис | 22,576 |
| Merck & Co | 20,375 |
| Wyeth | 16,884 |
| Лилли | 15,691 |
| Бристоль-Майерс Сквибб | 13,861 |
| Boehringer Ingelheim | 13,860 |
| Amgen | 13,858 |
| Abbott Laboratories | 12,395 |
| Байер | 10,162 |
| Такеда | 8,716 |
| Schering-Plough | 8,561 |
| Тева | 7,821 |
| Genentech | 7,640 |
| Астеллас | 7,390 |
| Ново Нордиск | 7,087 |
| Дайичи Санкё | 6,790 |
| Baxter International | 6,461 |
| Merck KGaA | 5,643 |
| Eisai | 4,703 |
В 2011 году глобальные расходы на рецептурные лекарства превысили 954 миллиарда долларов, несмотря на то, что рост в Европе и Северной Америке несколько замедлился. На Соединенные Штаты приходится более трети мирового фармацевтического рынка, годовой объем продаж которых составляет 340 миллиардов долларов, за ними следуют ЕС и Япония.[88] Развивающиеся рынки, такие как Китай, Россия, Южная Корея и Мексика, опередили этот рынок, увеличившись на 81 процент.[89][90]
Десять самых продаваемых лекарств в 2013 году составили 75,6 млрд долларов, включая противовоспалительный препарат. Хумира является самым продаваемым лекарством в мире с продажами в 10,7 миллиарда долларов. Второе и третье место по продажам заняли Enbrel и Remicade соответственно.[91] В тройку самых продаваемых лекарств в США в 2013 году вошли Abilify (6,3 миллиарда долларов), Nexium (6 миллиардов долларов) и Humira (5,4 миллиарда долларов).[92] Самый продаваемый препарат на свете, Липитор, в среднем 13 миллиардов долларов в год и чистая прибыль в размере 141 миллиард долларов за время своего существования до истечения срока действия патента Pfizer в ноябре 2011 года.
IMS Health публикует анализ тенденций, ожидаемых в фармацевтической промышленности в 2007 году, в том числе рост прибыли в большинстве секторов, несмотря на потерю некоторых патентов, и новые «блокбастеры» на горизонте.[93]
Патенты и дженерики
В зависимости от ряда соображений компания может подать заявку и получить патент в отношении препарата или процесса производства препарата, предоставление исключительных прав обычно на срок около 20 лет.[94] Однако только после тщательного изучения и тестирования, которое занимает в среднем от 10 до 15 лет, государственные органы дадут компании разрешение на маркетинг и продажу препарата.[95] Патентная защита позволяет владельцу патента возмещать затраты на исследования и разработки за счет высокой маржи прибыли для фирменный препарат, средство, медикамент. Когда истекает срок патентной защиты препарата, общий препарат обычно разрабатывается и продается конкурирующей компанией. Разработка и одобрение дженериков обходятся дешевле, что позволяет продавать их по более низкой цене. Часто владелец фирменного препарата представляет непатентованную версию до истечения срока действия патента, чтобы получить фору на рынке дженериков.[96] Таким образом, реструктуризация стала обычным делом из-за истечения срока действия патентов на продукты, выпущенные в «золотую эру» отрасли в 1990-х годах, и неспособности компаний разработать достаточное количество новых продуктов-блокбастеров для замещения упущенных доходов.[97]
Рецепты
В США стоимость рецептов увеличивалась за период с 1995 по 2005 год на 3,4 миллиарда в год, т.е. на 61 процент. Розничная продажа рецептурных препаратов подскочила на 250 процентов с 72 до 250 миллиардов долларов, а средняя цена рецептурных препаратов увеличилась более чем вдвое с 30 до 68 долларов.[98]
Маркетинг
Реклама широко распространена в медицинских журналах, а также в более распространенных СМИ. В некоторых странах, особенно в США, им разрешено размещать рекламу непосредственно для широкой публики. Фармацевтические компании обычно нанимают продавцов (часто называемых «фармацевтическими представителями» или, как более старый термин, «медперсоналом») для непосредственного и личного маркетинга врачам и другим поставщикам медицинских услуг. В некоторых странах, особенно в США, в фармацевтических компаниях также работают лоббисты влиять на политиков. Маркетинг рецептурных лекарств в США регулируется федеральными властями. Закон о маркетинге рецептурных лекарств 1987 г..
Медицинским работникам
Книга Плохая Фарма также обсуждает влияние представителей лекарственных средств, то, как фармацевтические компании нанимают авторов-призраков для написания статей для ученых для публикации, насколько на самом деле независимы академические журналы, как фармацевтические компании финансируют непрерывное образование врачей и как часто финансируются группы пациентов. по отраслям.[99]
Прямая потребительская реклама
С 1980-х годов стали важны новые методы маркетинга рецептурных лекарств для потребителей. Прямая к потребителю реклама в средствах массовой информации была легализована в Руководстве FDA для промышленности по широковещательной рекламе, ориентированной на потребителей.
Споры
Маркетинг и лоббирование наркотиков
Вокруг фармацевтического маркетинга и влияния растет споры. Были обвинения и выводы о влиянии на врачей и других медицинских работников через фармацевтических представителей, включая постоянное предоставление маркетинговых «подарков» и предвзятой информации медицинским работникам;[100] широко распространенная реклама в журналах и на конференциях; финансирование независимых организаций здравоохранения и кампаний по укреплению здоровья; лоббирование врачей и политиков (больше, чем в любой другой отрасли в США[101]); спонсорство медицинские школы или обучение медсестер; спонсорство продолжающихся образовательных мероприятий, влияющих на учебную программу;[102] и наем врачей в качестве оплачиваемых консультантов в медицинские консультативные советы.
Некоторые группы защиты, такие как Нет бесплатного обеда и AllTrials, критикуют влияние маркетинга лекарств на врачей, потому что они говорят, что врачи предвзято выписывают продаваемые лекарства, даже если другие могут быть дешевле или лучше для пациента.[103]
Были связанные обвинения в разжигание болезней[104] (чрезмерно медикаментозное лечение) для расширения рынка лекарств. Инаугурационная конференция по этой теме прошла в Австралии в 2006 году.[105] В 2009 году за счет средств Правительства Национальная служба прописывания запустил «Поиск доказательств - признание шумихи» программа, направленная на обучение врачей общей практики методам независимого анализа наркотиков.[106]
Мета-анализ показал, что психиатрические исследования, спонсируемые фармацевтическими компаниями, в несколько раз чаще дадут положительные результаты, а если в них участвует сотрудник фармацевтической компании, эффект еще больше.[107][108][109] Влияние также распространилось на подготовку врачей и медсестер в медицинских школах, с которой ведется борьба.
Утверждалось, что дизайн Диагностическое и Статистическое Руководство по Психическим Расстройствам и расширение критериев представляет собой растущую медикализацию человеческой природы, или "разжигание болезней", движимый влиянием фармацевтических компаний на психиатрию.[110] Возможность прямого конфликт интересов был поднят отчасти потому, что примерно половина авторов, которые выбрали и определили психические расстройства DSM-IV, имели или ранее имели финансовые отношения с фармацевтической промышленностью.[111]
В США, начиная с 2013 года, в соответствии с Отчетами о финансовой прозрачности врачей (часть Закона о солнечном свете) Центры услуг Medicare и Medicaid должны собирать информацию от соответствующих производителей и групповых закупочных организаций, чтобы сообщать информацию о своих финансовых отношениях с врачи и больницы. Данные публикуются на веб-сайте Центров услуг Medicare и Medicaid. Ожидается, что отношения между врачами и фармацевтической промышленностью станут полностью прозрачными.[112]
В отчете, проведенном Центр отзывчивой политикиВ 2017 году более 1100 лоббистов в той или иной степени работали в фармацевтическом бизнесе. В первом квартале 2017 года производители товаров для здоровья и фармацевтическая промышленность потратили 78 миллионов долларов на лоббирование членов Конгресса США.[113]
Цены на лекарства
Утверждалось, что ценообразование на фармацевтические препараты становится серьезной проблемой для систем здравоохранения.[114]
Нормативные вопросы
Бен Голдакр утверждал, что регулирующие органы, такие как Агентство по регулированию лекарственных средств и товаров медицинского назначения (MHRA) в Великобритании или Управление по контролю за продуктами и лекарствами (FDA) в Соединенных Штатах - продвигает интересы фармацевтических компаний, а не интересы общества, благодаря постоянному обмену сотрудниками между регулирующим органом и компаниями, а также развитию дружеских отношений между регулирующим органом и сотрудниками компании.[115] Он утверждает, что регулирующие органы не требуют, чтобы новые лекарства предлагали улучшения по сравнению с уже имеющимися, или даже чтобы они были особенно эффективными.[115]
Другие утверждали, что чрезмерное регулирование подавляет терапевтические инновации и что текущая стоимость клинических испытаний, требуемых регулирующими органами, не позволяет в полной мере использовать новые генетические и биологические знания для лечения болезней человека. В отчете Совета советников президента по науке и технологиям за 2012 год содержится несколько ключевых рекомендаций по снижению нормативной нагрузки на разработку новых лекарств, в том числе 1) расширение использования FDA ускоренных процессов утверждения, 2) создание ускоренного пути утверждения для лекарств, предназначенных для использования. в узко определенных группах населения, и 3) осуществление пилотных проектов, направленных на оценку осуществимости нового адаптивного процесса утверждения лекарств.[116]
Фармацевтическое мошенничество
Примеры и перспективы в этом разделе имеют дело в первую очередь с США и не представляют мировое мнение предмета. (Август 2015 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Фармацевтическое мошенничество включает в себя обманы, которые приносят финансовую выгоду фармацевтической компании. Это влияет на людей и общественный и частные страховщики. Есть несколько разных схем[117] используется для обмана система здравоохранения которые относятся к фармацевтической промышленности. К ним относятся: нарушения надлежащей производственной практики (GMP), внепрограммный маркетинг, мошенничество с лучшими ценами, мошенничество с CME, ценовая отчетность по программе Medicaid и готовые лекарственные препараты.[118] Из этой суммы 2,5 миллиарда долларов было возвращено через Закон о ложных исках дел в 2010 финансовом году. Примеры случаев мошенничества включают GlaxoSmithKline Расчет за 3 миллиарда долларов, Pfizer Урегулирование в размере 2,3 миллиарда долларов и Merck & Co. Урегулирование 650 миллионов долларов. Ущерб от мошенничества может быть возмещен с помощью Закон о ложных исках, чаще всего под Qui tam положения, которые вознаграждают человека за то, что он "осведомитель", или же родственник (закон).[119]
Каждая крупная компания, продающая антипсихотические препараты -Бристоль-Майерс Сквибб, Эли Лилли и компания, Pfizer, АстраЗенека и Джонсон и Джонсон- либо урегулировал недавние правительственные дела в соответствии с Законом о ложных исках на сотни миллионов долларов, либо в настоящее время расследуется на предмет возможного мошенничества в сфере здравоохранения. По обвинению в незаконном маркетинге в прошлом году два поселения установили рекорд по самым крупным уголовным штрафам, когда-либо наложенных на корпорации. Один из них был связан с антипсихотическим препаратом Эли Лилли. Зипрекса, а другие участвующие Bextra. В случае с Bextra правительство также обвинило Pfizer в незаконном сбыте другого антипсихотического средства, Геодон; Pfizer урегулировал эту часть иска на сумму 301 миллион долларов, не признав никаких нарушений.[120]
2 июля 2012 г. GlaxoSmithKline признал себя виновным по уголовным обвинениям и согласился на урегулирование крупнейшего в США дела о мошенничестве в сфере здравоохранения и крупнейшего платежа фармацевтической компании на 3 миллиарда долларов.[121] Мировое соглашение связано с незаконным продвижением компанией рецептурных лекарств, отказом от предоставления данных о безопасности,[122] подкуп врачей и продвижение лекарств для целей, для которых у них нет лицензии. Применяемые наркотики были Паксил, Веллбутрин, Advair, Ламиктал, и Зофран для использования не по назначению, без покрытия. Те и наркотики Имитрекс, Лотронекс, Flovent, и Валтрекс были вовлечены в схема отдачи.[123][124][125]
Ниже приводится список четырех крупнейших расчетов, достигнутых с фармацевтическими компаниями с 1991 по 2012 год, в порядке убывания размера общего урегулирования. Судебные иски к фармацевтической промышленности за последние два десятилетия сильно различались, в том числе Мошенничество с Medicare и Medicaid, не по назначению продвижение и неадекватная производственная практика.[126][127]
| Компания | Урегулирование | Нарушение (я) | Год | Товары) | Якобы нарушенные законы (если это применимо) |
|---|---|---|---|---|---|
| GlaxoSmithKline[128] | 3 миллиарда долларов | Off-label продвижение / нераскрытие данных о безопасности | 2012 | Avandia/Веллбутрин/Паксил | Закон о ложных исках/FDCA |
| Pfizer[129] | 2,3 миллиарда долларов | Off-label продвижение /откаты | 2009 | Bextra/Геодон/ Зивокс/Лирика | Закон о ложных исках / FDCA |
| Abbott Laboratories[130] | 1,5 миллиарда долларов | Off-label продвижение | 2012 | Депакоте | Закон о ложных исках / FDCA |
| Эли Лилли[131] | 1,4 миллиарда долларов | Off-label продвижение | 2009 | Зипрекса | Закон о ложных исках / FDCA |
Клинические испытания
Из-за неоднократных обвинений и выводов о том, что некоторые клинические испытания, проводимые или финансируемые фармацевтическими компаниями, могут давать только положительные результаты для предпочтительного лекарства, эта отрасль стала гораздо более внимательно изучаться независимыми группами и правительственными агентствами.[132]
В ответ на конкретные случаи, когда не были опубликованы неблагоприятные данные исследований, спонсируемых фармацевтическими компаниями, Фармацевтические исследования и производители Америки опубликовали новые правила, призывающие компании сообщать обо всех результатах и ограничивать финансовое участие исследователей в фармацевтических компаниях.[133] Конгресс США подписал закон, требующий проведения клинических испытаний фазы II и фазы III. зарегистрированный спонсором на Clinicaltrials.gov веб-сайт, управляемый NIH.[134]
Исследователи лекарств, не нанятые непосредственно фармацевтическими компаниями, часто обращаются к компаниям за грантами, а компании часто обращаются к исследователям за исследованиями, которые сделают их продукты привлекательными. Спонсируемые исследователи получают вознаграждение от фармацевтических компаний, например, в виде поддержки расходов на проведение конференций / симпозиумов. Сценарии лекций и даже журнальные статьи, представленные академическими исследователями, на самом деле могут быть «написаны призраком» фармацевтическими компаниями.[135]
Расследование ProPublica обнаружил, что по крайней мере 21 врач получил более 500000 долларов за выступления и консультации от производителей лекарств с 2009 года, при этом половина самых высокооплачиваемых специалистов работают в психиатрияи около 2 миллиардов долларов, выплаченных врачам за такие услуги. АстраЗенека, Джонсон и Джонсон и Эли Лилли заплатили миллиарды долларов в рамках федеральных расчетов по обвинениям в том, что они платили врачам за продвижение лекарств для несанкционированного использования. Некоторые известные медицинские школы с тех пор ужесточили правила принятия преподавателями таких платежей фармацевтическими компаниями.[136]
В отличие от этой точки зрения, статья и соответствующая редакционная статья в Медицинский журнал Новой Англии в мае 2015 года подчеркнули важность взаимодействия фармацевтических компаний и врачей для разработки новых методов лечения и заявили, что моральное возмущение отраслевыми должностными преступлениями неоправданно заставило многих переоценить проблемы, создаваемые финансовым конфликтом интересов. В статье отмечается, что основные медицинские организации, такие как Национальный центр развития трансляционных наук при Национальных институтах здравоохранения, Совет советников президента по науке и технологиям, Всемирный экономический форум, Фонд Гейтса, Wellcome Trust и Food and Drug Администрация поощряла более тесное взаимодействие между врачами и промышленностью, чтобы принести большую пользу пациентам.[137][138]
Ответ на COVID-19
В ноябре 2020 года несколько фармацевтических компаний объявили об успешных испытаниях вакцин против Covid-19 с эффективностью от 90 до 95% в предотвращении инфекции. Согласно заявлениям компании и данным, рассмотренным внешними аналитиками, эти вакцины стоят от 3 до 37 долларов за дозу.[139] The Wall Street Journal опубликовал редакционную статью с призывом к присуждению Нобелевской премии мира за это достижение. [140]
Врачи без границ предупредил, что высокие цены и монополия на лекарства, тесты и вакцины продлят пандемию и унесут жизни. Они призвали правительства предотвратить спекуляцию, используя принудительные лицензии по мере необходимости, как это уже было сделано Канадой, Чили, Эквадором, Германией и Израилем.[141]
20 февраля 46 законодателей США призвали правительство США не предоставлять монопольных прав при выдаче налогоплательщикам денег на разработку любых вакцин и препаратов для лечения коронавируса, чтобы не передавать частным производителям исключительный контроль над ценами и доступностью.[142]
В Соединенных Штатах правительство подписало соглашения, в которых субсидировались исследования и разработки и / или строительство заводов по производству потенциальных терапевтических средств против Covid 19. Как правило, соглашение предусматривало получение государством права собственности на определенное количество доз продукта без дополнительной оплаты. Например, под эгидой операции Warp Speed в США правительство субсидировало исследования, связанные с вакцинами и терапевтическими препаратами Covid 19 в Regeneron.[143], Johnson and Johnson, Moderna, AstraZeneca, Novavax, Pfizer и GSK. Типичные условия включали субсидии на исследования в размере от 400 миллионов до 2 миллиардов долларов и включали государственную собственность на первые 100 миллионов доз любой успешно разработанной вакцины против Covid 19. [144]
Американская фармацевтическая компания Галаад искал и получил статус орфанных препаратов за Ремдесивир из США Управление по контролю за продуктами и лекарствами (FDA) 23 марта 2020 года. Это положение предназначено для поощрения разработки лекарств, затрагивающих менее 200 000 американцев, путем предоставления производителю усиленных и расширенных юридических монопольных прав, а также освобождения от налогов и государственных сборов.[145][146] Ремдесивир - кандидат для лечения COVID-19; на момент предоставления статуса менее 200 000 американцев были заражены COVID-19, но их число быстро росло по мере того, как COVID-19 пандемия достигли США, и вскоре переступить порог считали неизбежным.[145][146] Ремдесивир был разработан компанией Gilead с бюджетом более 79 миллионов долларов США.[146] В мае 2020 года Gilead объявила, что бесплатно предоставит федеральному правительству первые 940 000 доз ремдесивира.[147] После бурной реакции общественности 25 марта компания Gilead отказалась от статуса "орфанного препарата" ремдесивира.[148] Gilead сохраняет патенты на ремдесивир сроком на 20 лет в более чем 70 странах.[141] В мае 2020 года компания также объявила, что ведет переговоры с несколькими компаниями-производителями дженериков о предоставлении прав на производство ремдесивира для развивающихся стран и с Патентным фондом лекарственных средств для обеспечения более широкого доступа к генерикам. [149]
Производитель диагностических тестов в США Cepheid Inc получил US FDA Разрешение на использование в чрезвычайных ситуациях для теста COVID-19 под названием Xpert Xpress SARS-CoV-2. В тесте используются те же машины, которые обычно используются для тестирования туберкулез и ВИЧ, среди других заболеваний и дает результаты за 45 минут, быстрее, чем некоторые другие тесты. Cepheid объявила, что в развивающихся странах будет взимать 19,80 долларов США за тест. Врачи без границ заявил, что эта цена недоступна в странах, где люди живут менее чем на два доллара в день. Они подсчитали, что стоимость проведения теста для Cepheid составляет всего 3 доллара, и назвали предлагаемую цену спекуляцияс просьбой, чтобы Cepheid получила более умеренную прибыль, продав тесты по 5 долларов США за штуку.[141] В Группа действий по лечению (TAG) поддержал этот запрос, заявив, что разработка тестов, их закупка и глобальное развертывание осуществлялись за счет государственных средств, а владельцы Cepeid получили прибыль в размере 3 миллиардов долларов в 2019 году. TAG также начал программу «Время за 5 долларов». " кампания.[150] Аналогичные тесты для вирус гепатита С (еще один РНК-вирус) стоимостью от 50 центов США (за пятиминутку) тесты на антитела) до 5 долларов США (для более сложных геномных тестов, подобных тесту Cepheid). Широко распространенное тестирование этих дешевых тестов имело решающее значение для ликвидации гепатита С в Египте.[151][152] и аналогичные методы массового тестирования были успешно использован против COVID-19.[153]
Развивающийся мир
Патенты
Патенты подвергались критике в развивающихся странах, поскольку их считали[ВОЗ?] уменьшить доступ к существующим лекарствам.[154] Сочетание патентов и всеобщего доступа к медицине потребует эффективной международной политики ценовая дискриминация. Более того, под ПОЕЗДКИ соглашение Мировая Торговая Организациястраны должны разрешить патентование фармацевтических продуктов. В 2001 году ВТО приняла Дохинская декларация, который указывает на то, что соглашение TRIPS следует читать с учетом целей общественного здравоохранения, и разрешает некоторые методы обхода фармацевтических монополий: через принудительное лицензирование или же параллельный импорт, даже до истечения срока действия патента.[155]
В марте 2001 г. 40 транснациональных фармацевтических компаний подали иски против Южная Африка для своего Закон о лекарствах, что позволило производить непатентованные антиретровирусные препараты (АРВ) для лечения ВИЧ, несмотря на то, что эти препараты были запатентованы.[156] ВИЧ был и остается эпидемия в Южной Африке, а АРВ-препараты в то время стоили от 10 000 до 15 000 долларов США на пациента в год. Это было недоступно для большинства граждан Южной Африки, поэтому правительство Южной Африки обязалось предоставлять АРВ-препараты по ценам, близким к тем, которые люди могли себе позволить. Для этого им придется игнорировать патенты на лекарства и производить генерики внутри страны (используя принудительную лицензию) или импортировать их из-за границы. После международного протеста в защиту прав населения (включая сбор 250 000 подписей Médecins Sans Frontières), правительства нескольких развитых стран (включая Нидерланды, Германию, Францию, а позже и США) поддержали правительство Южной Африки, и в апреле того же года дело было закрыто.[157]
В 2016 году GlaxoSmithKline (шестая по величине фармацевтическая компания в мире) объявила, что откажется от своих патентов в бедных странах, чтобы позволить независимым компаниям производить и продавать версии своих лекарств в этих регионах, тем самым расширяя доступ к ним общественности.[158] GlaxoSmithKline опубликовал список из 50 стран, в которых они больше не будут иметь патенты, что затронуло один миллиард человек во всем мире.
Благотворительные программы
В 2011 году четыре из 20 крупнейших корпоративных благотворительных пожертвований и восемь из 30 крупнейших корпоративных благотворительных пожертвований поступили от производителей фармацевтической продукции. Основная часть корпоративных благотворительных пожертвований (69% по данным на 2012 год) поступает в виде безналичных благотворительных пожертвований, большинство из которых опять же являются пожертвованиями фармацевтических компаний. [159]
Благотворительные программы и усилия фармацевтических компаний по открытию и разработке лекарств включают:
- "Merckдар », в котором миллиарды речная слепота лекарства были подарены в Африке[160]
- Pfizerподарок бесплатно / со скидкой флуконазол и другие препараты для СПИД в Южная Африка[161]
- GSKобязательство предоставить ВОЗ бесплатные таблетки альбендазола до и до ликвидации лимфатический филяриатоз Мировой.
- В 2006 г. Новартис выделил 755 миллионов долларов США на инициативы корпоративного гражданства по всему миру, уделяя особое внимание улучшению доступа к лекарствам в развивающихся странах посредством своих проектов Access to Medicine, включая пожертвования лекарств пациентам, пострадавшим от проказа, туберкулез, и малярия; Гливек программы помощи пациентам; и помощь для поддержки крупных гуманитарных организаций, нуждающихся в неотложной медицинской помощи.[162]
Смотрите также
- Теория заговора Big Pharma
- Клинические испытания
- Разработка лекарств
- Открытие наркотиков
- Легальная торговля наркотиками
- Список фармацевтических компаний
- Фармацевтический маркетинг
- Аптека
- Unitaid
Рекомендации
- ^ Макгуайр, Джон Л .; Хасскарл, Хорст; Боде, Герд; Клингманн, Ингрид; Зан, Мануэль (2007). Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a19_273.pub2. ISBN 978-3527306732.
- ^ Bozenhardt, Erich H .; Боженхардт, Герман Ф. (18 октября 2018 г.). "Вы слишком много просите наполнителя?". Фармацевтический Интернет (Гостевая колонка). VertMarkets. Получено 30 октября 2018.
Основная миссия фармацевтической промышленности - производство продуктов для пациентов, которые могут их вылечить, вакцинировать или облегчить симптомы, часто путем производства жидких инъекционных или пероральных твердых веществ, среди других методов лечения.
- ^ Многонациональные корпорации, включая Merck, Хоффман-Ла Рош, Берроуз-Веллком (ныне часть Глаксо Смит Клайн), Abbott Laboratories, Эли Лилли и Upjohn (теперь часть Pfizer) начинался как местные аптеки в середине 1800-х годов.
- ^ «Лучшие фармацевтические препараты: Введение: ВОЗНИКНОВЕНИЕ ФАРМАЦЕВТИЧЕСКОЙ НАУКИ И ПРОМЫШЛЕННОСТИ: 1870-1930».
- ^ Снидер, Уолтер (31 октября 2005 г.). Открытие лекарств: история. Джон Вили и сыновья. С. 155–156. ISBN 978-0-470-01552-0.
- ^ а б Расмуссен, Николас (2006). «Создание первого антидепрессанта: амфетамин в американской медицине, 1929-1950». J Hist Med Allied Sci. 61 (3): 288–323. Дои:10.1093 / jhmas / jrj039. PMID 16492800. S2CID 24974454.
- ^ Расмуссен Н. (июнь 2008 г.). "Первая в Америке эпидемия амфетамина 1929–1971 гг.". Американский журнал общественного здравоохранения. 98 (6): 974–985. Дои:10.2105 / AJPH.2007.110593. ЧВК 2377281. PMID 18445805.
- ^ Ясиры З., Шорвон С.Д. (декабрь 2012 г.). «Как фенобарбитал произвел революцию в терапии эпилепсии: история фенобарбитальной терапии эпилепсии за последние 100 лет». Эпилепсия. 53 Дополнение 8: 26–39. Дои:10.1111 / epi.12026. PMID 23205960. S2CID 8934654.
- ^ Лопес-Муньос Ф., Уча-Удабе Р., Аламо С. (декабрь 2005 г.). «История барбитуратов через столетие после их клинического внедрения». Нейропсихиатр Dis Treat. 1 (4): 329–43. ЧВК 2424120. PMID 18568113.
- ^ «Поправки по борьбе со злоупотреблением наркотиками 1965 года». NEJM. 273 (22): 1222–1223. 25 ноября 1965 г. Дои:10.1056 / NEJM196511252732213.
Сотрудники Управления по санитарному надзору за качеством пищевых продуктов и медикаментов, осознающие серьезность проблемы, подсчитали, что примерно половина из 9 000 000 000 капсул и таблеток барбитуратов и амфетамина, производимых ежегодно в этой стране, направляется на незаконное использование. Прибыль от незаконной продажи этих наркотиков доказала свою привлекательность для организованной преступности, поскольку амфетамин можно купить оптом по цене менее 1 доллара за 1000 капсул, но при продаже на нелегальном рынке он приносит от 30 до 50 долларов за 1000 капсул. а при продаже отдельному покупателю планшет может принести от 10 до 25 центов.
- ^ «Седативно-снотворные - Барбитураты - I». NEJM. 255 (24): 1150–1151. 1956. Дои:10.1056 / NEJM195612132552409.
Барбитураты, введенные в медицину Э. Фишером и Дж. Фон Мерингом1 в 1903 г., безусловно, являются одними из наиболее широко используемых лекарств в медицине. Ежегодно производится около 400 тонн этих агентов; этого достаточно, чтобы каждую ночь в течение этого периода усыпить приблизительно 9 000 000 человек, если каждому давать 0,1 грамма. доза
- ^ Розенфельд Л. (декабрь 2002 г.). «Инсулин: открытие и споры». Clin. Chem. 48 (12): 2270–88. Дои:10.1093 / Clinchem / 48.12.2270. PMID 12446492.
- ^ а б (PDF) https://www.cdc.gov/nchs/data/nvsr/nvsr47/nvs47_28.pdf. Отсутствует или пусто
| название =(помощь) - ^ "cdc.gov" (PDF).
- ^ Сепковиц К.А. (июль 2011 г.). «Сто лет Сальварсана». N. Engl. J. Med. 365 (4): 291–3. Дои:10.1056 / NEJMp1105345. PMID 21793743.
- ^ Уильямс, KJ (1 августа 2009 г.). «Внедрение« химиотерапии »с использованием арсфенамина - первая волшебная пуля». Журнал Королевского медицинского общества. 102 (8): 343–348. Дои:10.1258 / jrsm.2009.09k036. ISSN 0141-0768. ЧВК 2726818. PMID 19679737.
- ^ Аминов Р.И. (2010). «Краткая история эпохи антибиотиков: извлеченные уроки и задачи на будущее». Передний микробиол. 1: 134. Дои:10.3389 / fmicb.2010.00134. ЧВК 3109405. PMID 21687759.
- ^ Хагер, Томас (2006). Демон под микроскопом: от больниц на полях сражений до нацистских лабораторий, героические поиски одним доктором первого в мире чудодейственного препарата (1-е изд.). Нью-Йорк: Книги Гармонии. ISBN 978-1-4000-8213-1.
- ^ «Факты о Нобелевской премии». nobelprize.org. Получено 19 мая 2016.
- ^ а б Катлер, Дэвид; Меара, Эллен (октябрь 2001 г.). «Изменения в возрастном распределении смертности за ХХ век» (PDF). Рабочий документ NBER № 8556. Дои:10.3386 / w8556.
- ^ а б Кляйн, Герберт (2012). История народонаселения США. Издательство Кембриджского университета. п. 167.
- ^ Параскандола, Джон (1980). История антибиотиков: симпозиум. Американский институт истории фармации № 5. ISBN 978-0-931292-08-8.
- ^ «Дифтерия - Хронология - История вакцин».
- ^ II, Томас Х. Мо (13 апреля 2005 г.). "Морис Р. Хиллеман, 85 лет; ученый разработал множество вакцин, которые спасли миллионы жизней - Los Angeles Times". Лос-Анджелес Таймс.
- ^ «Важные даты в истории законодательства США о пищевых продуктах и лекарствах».
- ^ "FDAReview.org, проект Независимого института".
- ^ «Сульфаниламидная катастрофа».
- ^ «История FDA - Часть II».
- ^ Заффири Л., Гарднер Дж., Толедо-Перейра Л. Х. (апрель 2012 г.). «История антибиотиков. От сальварсана до цефалоспоринов». J Invest Surg. 25 (2): 67–77. Дои:10.3109/08941939.2012.664099. PMID 22439833. S2CID 30538825.
- ^ Гамильтон-Миллер JM (март 2008 г.). «Разработка полусинтетических пенициллинов и цефалоспоринов». Int. J. Antimicrob. Агенты. 31 (3): 189–92. Дои:10.1016 / j.ijantimicag.2007.11.010. PMID 18248798.
- ^ Абрахам EP (1987). «Цефалоспорины 1945-1986». Наркотики. 34 Дополнение 2 (Дополнение 2): 1–14. Дои:10.2165/00003495-198700342-00003. PMID 3319494. S2CID 12014890.
- ^ а б Kingston W (июль 2004 г.). «Streptomycin, Schatz v. Waksman, и кредитный баланс за открытие». J Hist Med Allied Sci. 59 (3): 441–62. Дои:10.1093 / jhmas / jrh091. PMID 15270337. S2CID 27465970.
- ^ Нельсон М.Л., Леви С.Б. (декабрь 2011 г.). «История тетрациклинов». Анна. Акад. Наука. 1241 (1): 17–32. Bibcode:2011НЯСА1241 ... 17Н. Дои:10.1111 / j.1749-6632.2011.06354.x. PMID 22191524. S2CID 34647314.
- ^ «ЭРИТРОМИЦИН». Br Med J. 2 (4793): 1085–6. Ноябрь 1952 г. Дои:10.1136 / bmj.2.4793.1085. ЧВК 2022076. PMID 12987755.
- ^ Андерсон, Розалин (2012). Химический состав антибактериальных агентов, механизм действия, механизмы устойчивости и клиническое применение. Оксфорд: WiBlackwell. ISBN 9780470972458.
- ^ Отчет Федеральной торговой комиссии по производству антибиотиков, июнь 1958 г. (Вашингтон, округ Колумбия, правительственная типография, 1958 г.), стр. 98-120
- ^ Отчет Федеральной торговой комиссии по производству антибиотиков, июнь 1958 г. (Вашингтон, округ Колумбия, правительственная типография, 1958 г.), стр. 277
- ^ SWEET BH, HILLEMAN MR (ноябрь 1960 г.). «Вакуолизирующий вирус, С.В. 40». Proc. Soc. Exp. Биол. Med. 105 (2): 420–7. Дои:10.3181/00379727-105-26128. PMID 13774265. S2CID 38744505.
- ^ Шах К., Натансон Н. (январь 1976 г.). «Воздействие SV40 на человека: обзор и комментарии». Являюсь. J. Epidemiol. 103 (1): 1–12. Дои:10.1093 / oxfordjournals.aje.a112197. PMID 174424.
- ^ «Исследования: нет доказательств того, что SV40 связан с раком - Национальный институт рака». Архивировано из оригинал 28 октября 2014 г.
- ^ "История вакцин - проект истории вакцин Колледжа врачей Филадельфии".
- ^ «Профилактика кори, краснухи, синдрома врожденной краснухи и паротита, 2013».
- ^ Блох А.Б., Оренштейн В.А., Стетлер Х.С. и др. (1985). «Влияние вакцинации против кори на здоровье в США». Педиатрия. 76 (4): 524–32. PMID 3931045.
- ^ Insull W (январь 2009 г.). «Патология атеросклероза: образование бляшек и реакция бляшек на лечение». Американский журнал медицины. 122 (1 приложение): S3 – S14. Дои:10.1016 / j.amjmed.2008.10.013. PMID 19110086.
- ^ Гаддам К.К., Верма А., Томпсон М., Амин Р., Вентура Х. (май 2009 г.). «Гипертония и сердечная недостаточность в различных формах». Медицинские клиники Северной Америки. 93 (3): 665–80. Дои:10.1016 / j.mcna.2009.02.005. PMID 19427498. Получено 20 июн 2009.
- ^ Agabiti-Rosei E (сентябрь 2008 г.). «От макро- к микроциркуляции: преимущества при гипертонии и диабете». Журнал гипертонии. 26 (Приложение 3): S15–21. Дои:10.1097 / 01.hjh.0000334602.71005.52. PMID 19363848.
- ^ Мерфи Б.П., Стэнтон Т., Данн Ф.Г. (май 2009 г.). «Гипертония и ишемия миокарда». Медицинские клиники Северной Америки. 93 (3): 681–95. Дои:10.1016 / j.mcna.2009.02.003. PMID 19427499. Получено 20 июн 2009.
- ^ Белый ВБ (май 2009 г.). «Определение проблемы лечения пациента с гипертонической болезнью и артритом». Американский журнал медицины. 122 (5 Прил.): S3–9. Дои:10.1016 / j.amjmed.2009.03.002. PMID 19393824.
- ^ Чыонг Л.Д., Шен С.С., Парк М.Х., Кришнан Б. (февраль 2009 г.). «Диагностика неопухолевых поражений в образцах нефрэктомии». Архив патологии и лабораторной медицины. 133 (2): 189–200. Дои:10.1043/1543-2165-133.2.189 (неактивно 10 ноября 2020 г.). PMID 19195963. Получено 20 июн 2009.CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
- ^ Трэйси Р. Э., Белый С. (февраль 2002 г.). «Метод количественной оценки узловой гиперплазии коры надпочечников при вскрытии: некоторое использование метода для выявления гипертонии и атеросклероза». Анналы диагностической патологии. 6 (1): 20–9. Дои:10.1053 / adpa.2002.30606. PMID 11842376.
- ^ Aronow WS (август 2008 г.). «Гипертония и пожилой диабетик». Клиники гериатрической медицины. 24 (3): 489–501, vi – vii. Дои:10.1016 / j.cger.2008.03.001. PMID 18672184. Получено 20 июн 2009.
- ^ Гарднер А.В., Афак А (2008). «Тактика лечения заболеваний периферических артерий нижних конечностей». Журнал сердечно-легочной реабилитации и профилактики. 28 (6): 349–57. Дои:10.1097 / HCR.0b013e31818c3b96. ЧВК 2743684. PMID 19008688.
- ^ Ново С., Лунетта М., Эвола С., Ново Г. (январь 2009 г.). «Роль БРА в терапии артериальной гипертензии и профилактике сердечно-сосудистых событий». Текущие цели в отношении лекарств. 10 (1): 20–5. Дои:10.2174/138945009787122897. PMID 19149532. Архивировано из оригинал 12 января 2013 г.. Получено 20 июн 2009.
- ^ Крейг WM (1939). «Хирургическое лечение гипертонии». Br Med J. 2 (4120): 1215–9. Дои:10.1136 / bmj.2.4120.1215. ЧВК 2178707. PMID 20782854.
- ^ Снидер, Уолтер (2005). Открытие наркотиков. История. Нью-Йорк: Вили. п. 371.
- ^ Бейер К.Х. (1993). «Хлоротиазид. Как тиазиды появились в качестве антигипертензивной терапии». Гипертония. 22 (3): 388–91. Дои:10.1161 / 01.hyp.22.3.388. PMID 8349332.
- ^ BORHANI NO, HECHTER HH (1964). "Последние изменения смертности от сердечно-сосудистых заболеваний в Калифорнии: эпидемиологическая оценка". Представитель общественного здравоохранения. 79 (2): 147–60. Дои:10.2307/4592077. JSTOR 4592077. ЧВК 1915335. PMID 14119789.
- ^ «Фонд Ласкера - Награды».
- ^ Райт, Джеймс М .; Musini, Vijaya M .; Гилл, Рупам (18 апреля 2018 г.). «Препараты первого ряда от гипертонии». Кокрановская база данных систематических обзоров. 4: CD001841. Дои:10.1002 / 14651858.CD001841.pub3. ISSN 1469-493X. ЧВК 6513559. PMID 29667175.
- ^ Стасон В.Б., Кэннон П.Дж., Хайнеманн Х.О., Лараг Дж.Х. (ноябрь 1966 г.). «Фуросемид. Клиническая оценка его мочегонного действия». Тираж. 34 (5): 910–20. Дои:10.1161 / 01.cir.34.5.910. PMID 5332332. S2CID 886870.
- ^ Блэк Дж. У., Кроутер А. Ф., Шанкс Р. Г., Смит Л. Х., Дорнхорст А. С. (1964). «Новый антагонист адренергических бетарецепторов». Ланцет. 283 (7342): 1080–1081. Дои:10.1016 / S0140-6736 (64) 91275-9. PMID 14132613.
- ^ Lv J, Perkovic V, Foote CV, Craig ME, Craig JC, Strippoli GF (2012). «Антигипертензивные средства для профилактики диабетической болезни почек». Кокрановская база данных Syst Rev. 12: CD004136. Дои:10.1002 / 14651858.CD004136.pub3. PMID 23235603.
- ^ "Краткая история противозачаточных таблеток - хронология приема таблеток | Необходимо знать | PBS". 7 мая 2010 г.
- ^ «Почему оральные контрацептивы просто известны как« Таблетки »"". smithsonianmag.com.
- ^ "BBC News | ЗДОРОВЬЕ | Краткая история таблетки".
- ^ «Одобрение FDA первого орального контрацептива, Эновида».
- ^ Кафе, Ребекка (4 декабря 2011 г.). "BBC News - Как противозачаточные таблетки изменили Великобританию". Новости BBC.
- ^ «Брошюра: История регулирования лекарственных средств в США».
- ^ Тоберт, Джонатан А. (июль 2003 г.). «Ловастатин и не только: история ингибиторов HMG-CoA редуктазы». Обзоры природы Drug Discovery. 2 (7): 517–526. Дои:10.1038 / nrd1112. ISSN 1474-1776. PMID 12815379. S2CID 3344720.
- ^ Эндо А (1 ноября 1992 г.). «Открытие и разработка ингибиторов HMG-CoA редуктазы». Журнал липидных исследований. 33 (11): 1569–82. PMID 1464741.
- ^ Эндо, Акира (2004). «Происхождение статинов». Серия международных конгрессов. 1262: 3–8. Дои:10.1016 / j.ics.2003.12.099.
- ^ Скандинавы, симвастат, выживание (ноябрь 1994 г.). «Рандомизированное исследование снижения уровня холестерина у 4444 пациентов с ишемической болезнью сердца: Скандинавское исследование выживаемости симвастатина (4S)». Ланцет. 344 (8934): 1383–9. Дои:10.1016 / S0140-6736 (94) 90566-5. PMID 7968073. S2CID 5965882.
- ^ "Национальный зал славы изобретателей награжден призывниками 2012 года". PRNewswire. Получено 11 мая 2014.
- ^ «Как один ученый, заинтригованный плесенью, нашел первый статин». Wall Street Journal. Получено 11 мая 2014.
- ^ «Годовой отчет о воздействии». Центр Тафтса по изучению разработки лекарств. Цитировать журнал требует
| журнал =(помощь) - ^ Outsourcing-Pharma.com. «Pfizer сотрудничает с Parexel и Icon в последних стратегических сделках в секторе CRO». Outsourcing-Pharma.com.
- ^ «Сколько новых лекарств одобрило FDA в прошлом году?». Pharmalot.com. Архивировано из оригинал 8 мая 2011 г.. Получено 23 апреля 2011.
- ^ "Исследование". Архивировано из оригинал 20 июля 2011 г.. Получено 24 ноября 2006.
- ^ а б Перри, Сьюзен (8 августа 2012 г.). «Дональд Лайт и Джоэл Лексчин в BMJ 2012; 345: e4348, цитируется в: Заявление Big Pharma об« инновационном кризисе »является мифом, говорят авторы BMJ». MinnPost. Получено 8 августа 2012.
- ^ «О PhRMA - PhRMA». Архивировано из оригинал 4 января 2013 г.. Получено 23 апреля 2011.
- ^ «Неужели модель фармацевтического блокбастера провалилась?». bain.com. Получено 19 мая 2016.
- ^ Харпер, Мэтью (10 февраля 2012 г.). «Поистине ошеломляющая стоимость изобретения новых лекарств». Forbes.
- ^ IMS Health (18 июня 2015 г.). «Достаточно ли защищены европейские биотехнологические компании?». Портал конкурентной разведки. Архивировано из оригинал 30 июня 2015 г.. Получено 27 июн 2015.
- ^ Либерти Л., Макослейн Дж. Н., Уокер С. (2011). «Стандартизация оценки пользы и риска новых лекарственных средств: практическое применение рамок для фармацевтических работников здравоохранения». Фарм Мед. 25 (3): 139–46. Дои:10.1007 / BF03256855. S2CID 45729390. Архивировано из оригинал 6 февраля 2012 г.. Получено 18 октября 2011.
- ^ «Электронная оранжевая книга». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Получено 31 мая 2007.
- ^ «Закон о лекарствах для сирот (с поправками)». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Получено 24 сентября 2007.
- ^ Гад, Шейн С., изд. (2010), «Процесс разработки лекарств и глобальный фармацевтический рынок», Энциклопедия фармацевтических наук, Дои:10.1002 / 9780470571224.pse127
- ^ (PDF) http://www.vfa.de/download/SHOW/en/statistics/pharmaceuticalmarket/vfastat_30_en_fa_mt.pdf/vfastat_30_en_sw_mt.pdf. Получено 24 марта 2008. Отсутствует или пусто
| название =(помощь)[мертвая ссылка] - ^ Херпер, Мэтью и Канг, Питер (22 марта 2006 г.). «Десять самых продаваемых лекарств в мире». Forbes. Получено 31 мая 2007.
- ^ «Создание связанных решений для повышения эффективности здравоохранения» (PDF). IMS Health.
- ^ Коллеве, Джулия (27 марта 2014 г.). «10 самых продаваемых в мире лекарств, отпускаемых по рецепту, заработали в прошлом году 75 миллиардов долларов». хранитель.
- ^ «100 лучших лекарств 2013 года по объему продаж - фармацевтическая статистика США».
- ^ «IMS Health прогнозирует рост мирового фармацевтического рынка на 5–6 процентов в 2007 году». IMS Health. 24 октября 2006 г.. Получено 19 июн 2007.
- ^ Часто задаваемые вопросы (FAQ) В архиве 25 февраля 2013 г. Wayback Machine
- ^ «Новые разрешения на лекарства в 2006 году» (PDF). Март 2007. Архивировано с оригинал (PDF) 28 февраля 2008 г.. Получено 23 февраля 2008.
- ^ «Оценка авторизованных дженериков в США» (PDF). IMS Consulting. Июнь 2006 г. Архивировано с оригинал (PDF) 28 февраля 2008 г.. Получено 23 февраля 2008.
- ^ «Санофи увольняет 1700 человек в США». Открытие и разработка лекарств.
- ^ «Здоровье и питание 2007 г. - перепись» (PDF). Бюро переписи населения США. Получено 19 мая 2016.
- ^ Голдакр, Бен (2014). Плохая фармацевтика: как фармацевтические компании вводят врачей в заблуждение и вредят пациентам (Первое американское издание в мягкой обложке). ISBN 9780865478060.
- ^ Кауфман, Марк (6 мая 2005 г.). "Генеральный директор Merck уходит в отставку, поскольку расследование по делу о наркотиках продолжается". Вашингтон Пост. Получено 23 мая 2007.
- ^ «Второе после никому лобби лекарств: как фармацевтическая промышленность добивается своего в Вашингтоне». publicintegrity.org. 7 июля 2005 г. Архивировано с оригинал 9 июня 2007 г.. Получено 23 мая 2007.
- ^ Мойнихан Р. (29 мая 2003 г.). «Финансирование образования фармацевтическими компаниями может быть заменено за небольшую часть его стоимости». BMJ. 326 (7400): 1163. Дои:10.1136 / bmj.326.7400.1163. ЧВК 1126044. PMID 12775595.
- ^ "Доктор Нет бесплатных обедов". Мать Джонс. Получено 19 мая 2016.
- ^ Мойнихан, Рэй; Касселс, Алан (2005). Продажа болезни: как фармацевтические компании превращают нас всех в пациентов. Воронье гнездо, Нью-Южный: Аллен и Анвин. ISBN 978-1-74114-579-3.
- ^ "Сборник статей о распространении болезней". Публичная научная библиотека. Архивировано из оригинал 7 июня 2007 г.. Получено 23 мая 2007.
- ^ "Исследования фармацевтического рынка, тенденции и аналитические отчеты". literated.com. Архивировано из оригинал 19 января 2016 г.. Получено 17 января 2016.
- ^ Бучковский, СС; Jewesson, PJ (апрель 2004 г.). «Промышленное спонсорство и авторство клинических исследований более 20 лет». Энн Фармакотер. 38 (4): 579–85. Дои:10.1345 / aph.1D267. PMID 14982982. S2CID 43544256.
- ^ Perlis RH, Perlis CS, Wu Y, Hwang C, Joseph M, Nierenberg AA (октябрь 2005 г.). «Промышленное спонсорство и финансовый конфликт интересов в отчетности о клинических испытаниях в психиатрии». Am J Psychiatry. 162 (10): 1957–60. Дои:10.1176 / appi.ajp.162.10.1957. PMID 16199844.
- ^ Тунгараза, Т; Пул, Р. (июль 2007 г.). «Влияние авторства и спонсорства фармацевтических компаний на результаты испытаний лекарств». Br J Психиатрия. 191 (1): 82–3. Дои:10.1192 / bjp.bp.106.024547. PMID 17602130.
- ^ Хили, Д. (2006). "Последняя мания: биполярное расстройство". PLOS Med. 3 (4): e185. Дои:10.1371 / journal.pmed.0030185. ЧВК 1434505. PMID 16597178.
- ^ Косгроув, Лиза; Крымский, Шелдон; Виджаярагхаван, Маниша; Шнайдер, Лиза (2006). «Финансовые связи между членами группы DSM-IV и фармацевтической промышленностью». Психотерапия и психосоматика. 75 (3): 154–160. Дои:10.1159/000091772. PMID 16636630. S2CID 11909535.
- ^ «Открытые платежи». Февраль 2019.
- ^ Липтон, Эрик; Томас, Кэти (29 мая 2017 г.). "Боевой клич наркобизнеса из-за цен: вините других". Нью-Йорк Таймс. Получено 30 мая 2017.
- ^ Ценообразование на фармацевтические препараты становится серьезной проблемой для систем здравоохранения.
- ^ а б Голдакр, Бен (2014). Плохая фармацевтика: как фармацевтические компании вводят врачей в заблуждение и вредят пациентам (Первое американское издание в мягкой обложке). С. 123–124. ISBN 9780865478060.
- ^ (PDF) http://www.whitehouse.gov/sites/default/files/microsites/ostp/pcast-fda-final.pdf. Отсутствует или пусто
| название =(помощь) - ^ «Финансовые преступления в публичном отчете за 2006 год». ФБР. 2006 г.
- ^ "ФБР-мошенничество в сфере здравоохранения". ФБР.
- ^ "Департамент правосудия". Департамент правосудия. 19 марта 2015.
- ^ Уилсон, Дафф (2 октября 2010 г.). «Побочные эффекты могут включать судебные иски». Нью-Йорк Таймс.
- ^ «ГлаксоСмитКлайн». Новости BBC. 4 июля 2012 г.
- ^ «GlaxoSmithKline соглашается выплатить 3 миллиарда долларов в рамках урегулирования споров в США». Bloomberg. 2 июля 2012 г.
- ^ Могул, Фред (2 июля 2012 г.). «Нью-Йорк получит миллионы в поселении ГлаксоСмитКляйн». WNYC. Архивировано из оригинал 19 апреля 2013 г.. Получено 2 июля 2012.
- ^ "BBC News - GlaxoSmithKline выплатит 3 миллиарда долларов в связи с скандалом о мошенничестве с наркотиками в США". BBC Online. 2 июля 2012 г.. Получено 2 июля 2012.
- ^ Томас, Кэти и Шмидт, Майкл С. (2 июля 2012 г.). «Glaxo соглашается выплатить 3 миллиарда долларов в рамках урегулирования мошенничества». Нью-Йорк Таймс. Получено 3 июля 2012.
- ^ «Быстрое усиление уголовных и гражданских наказаний в отношении фармацевтической промышленности: 1991-2010 годы». Citizen.org. Архивировано из оригинал 16 мая 2016 г.. Получено 19 мая 2016.
- ^ Томас, Кэти; Шмидт, Майкл С. (2 июля 2012 г.). «GlaxoSmithKline соглашается выплатить 3 миллиарда долларов в рамках урегулирования мошенничества». Нью-Йорк Таймс.
- ^ «GlaxoSmithKline признает себя виновным и заплатит 3 миллиарда долларов за расследование заявлений о мошенничестве и непредставления данных о безопасности». 2 июля 2012 г.
- ^ «ОТДЕЛЕНИЕ ЮСТИЦИИ ОБЪЯВЛЯЕТ КРУПНЕЙШЕЕ МОШЕННИЧЕСТВО В ОБЛАСТИ ЗДРАВООХРАНЕНИЯ» (PDF). Министерство юстиции США. Получено 19 мая 2016.
- ^ «Abbott Labs заплатит 1,5 миллиарда долларов на расследование уголовных и гражданских расследований, связанных с продвижением Depakote вне лейбла». 7 мая 2012 г.
- ^ "# 09-038: Eli Lilly и компания соглашаются выплатить 1,415 миллиарда долларов для расследования обвинений в продвижении Zyprexa вне лейбла (2009-01-15)".
- ^ Бхандари М., Буссе Дж. У., Яковски Д., Монтори В. М., Шунеманн Х., Спраг С., Мирс Д., Шемич Е. Х., Хилс-Ансделл Д., Деверо П. Дж. (17 февраля 2004 г.). «Связь между отраслевым финансированием и статистически значимыми про-отраслевыми выводами медицинских и хирургических рандомизированных исследований». Журнал Канадской медицинской ассоциации. 170 (4): 477–480. Дои:10.1016 / 0006-291x (75) 90506-9. PMID 4.
- ^ Мойнихан Р. (29 мая 2003 г.). «Кто платит за пиццу? Переосмысление отношений между врачами и фармацевтическими компаниями. 2: Распутывание». BMJ. 326 (7400): 1193–1196. Дои:10.1136 / bmj.326.7400.1193. ЧВК 1126054. PMID 12775622.
- ^ «Новости компании Hogan & Hartson о регистрации фармацевтических исследований» (PDF). 3 марта 2008 г. Архивировано с оригинал (PDF) 25 июня 2008 г.. Получено 2 июн 2008.
- ^ Барнетт, Энтони (7 декабря 2003 г.). «Выявлено: как фармацевтические фирмы обманывают медицинские журналы». хранитель. Получено 19 мая 2016.
- ^ Орнштейн, Трейси Вебер, Чарльз (11 марта 2013 г.). "Доллары для документов - это миллионер". ProPublica. Получено 19 мая 2016.
- ^ Дражен, Джеффри М. (2015). «Пересмотр коммерческого и академического интерфейса - NEJM». Медицинский журнал Новой Англии. 372 (19): 1853–1854. Дои:10.1056 / NEJMe1503623. PMID 25946285.
- ^ Розенбаум, Лиза (2015). «Соединяя точки - переосмысление отношений между отраслью и врачом - NEJM». Медицинский журнал Новой Англии. 372 (19): 1860–1864. Дои:10.1056 / NEJMms1502493. PMID 25946288.
- ^ https://www.cnbc.com/2020/11/17/covid-vaccines-how-much-they-cost-whos-bought-them-and-how-theyre-stored.html
- ^ https://www.wsj.com/articles/pharma-dedules-the-nobel-peace-prize-for-the-covid-vaccines-11606950780?mod=e2fb&fbclid=IwAR3UWRQVGD-Po8S9rArqo4xf8ZIz_Lp8_Eqi
- ^ а б c «Нет спекуляции на лекарствах и вакцинах от COVID-19, - заявляет MSF». Médecins Sans Frontières (MSF) International.
- ^ Маццукато, Мариана; Моменгалибаф, Аззи (18 марта 2020 г.). «Фармацевтические компании убьют коронавирус». Нью-Йорк Таймс.
- ^ https://www.hhs.gov/about/news/2020/07/07/hhs-dod-collaborate-regeneron-large-scale-manufacturing-demonstration-project-covid-19-investigational-therapy-treatment.html
- ^ https://www.hhs.gov/coronavirus/explaining-operation-warp-speed/index.html
- ^ а б Лупкин, Сидней (24 марта 2020 г.). «FDA предоставляет экспериментальные препараты от коронавируса для лечения редких заболеваний». энергетический ядерный реактор. Получено 24 марта 2020.
- ^ а б c Конли, Джулия (24 марта 2020 г.). "'Это грандиозный скандал »: FDA Трампа предоставило фармацевтической компании эксклюзивное заявление о перспективном лекарстве от коронавируса». Общие мечты.
- ^ Будман, Эрик (18 мая 2020 г.). «Компания Gilead увеличивает объем пожертвований ремдесивира против Covid-19 для больниц США». statnews.com. Получено 19 июля 2020.
- ^ Лоусон, Алекс (25 марта 2020 г.). «Не позволяйте большой фармацевтике убивать, наживаясь на лечении COVID-19». Общие мечты.
- ^ https://www.gilead.com/news-and-press/company-statements/gilead-sciences-statement-on-remdesivir-global-supply
- ^ «Заявление группы действий по лечению о высокой цене теста Cepheid Xpert на COVID-19». Группа действий по лечению.
- ^ Haseltine, Уильям А. «Тесты на COVID-19 дороги, но не обязательно». Forbes.
- ^ Омран, Далия; Альбораи, Мохамед; Зайед, Рания А; Wi-Fi, Мохамед-Нагиб; Нагиб, Мерват; Эльтаббах, Мохамед; Абделлах, Мохамед; Шериф, Ахмед Фуад; Маклад, Сахар; Эльдемеллавы, Хеба Хэмди; Саад, Омар Халид; Хамисс, Доаа Мохамед; Эль-Кассас, Мохамед (14 октября 2018 г.). «На пути к ликвидации вируса гепатита С: опыт Египта, достижения и ограничения». Всемирный журнал гастроэнтерологии. 24 (38): 4330–4340. Дои:10.3748 / wjg.v24.i38.4330. ISSN 1007-9327. ЧВК 6189850. PMID 30344418.
- ^ Крисанти, Андреа; Кассоне, Антонио (20 марта 2020 г.). «В одном итальянском городе мы показали, что массовое тестирование может искоренить коронавирус». Хранитель.
- ^ См., Например: 't Hoen, Ellen. «ТАПИС, фармацевтические патенты и доступ к основным лекарственным средствам: долгий путь от Сиэтла до Дохи». Чикагский журнал международного права, 27 (43), 2002; Мусунгу, Сисуле Ф. и Сесилия О. «Использование гибких возможностей ТАПИС развивающимися странами: могут ли они предоставить доступ к лекарствам?» Комиссия по правам интеллектуальной собственности, инновациям и общественному здравоохранению, Всемирная организация здравоохранения, 2005 г.
- ^ «Декларация о соглашении ТРИПС и общественном здравоохранении». Мировая Торговая Организация. Получено 19 мая 2016.
- ^ Ассоциация производителей фармацевтической продукции против Президента Южной Африки (PMA), 2002 (2) SA 674 (CC) (Южная Африка).
- ^ Хелфер, Лоуренс Р.; Остин, Грэм У. (7 марта 2011 г.). Права человека и интеллектуальная собственность: отображение глобального интерфейса. Издательство Кембриджского университета. С. 145–148. ISBN 978-1-139-49691-9.
- ^ "GlaxoSmithKline" откажется от патентов в бедных странах для улучшения доступа к лекарствам'". Новости BBC. Получено 19 мая 2016.
- ^ «Успешный год для корпоративных пожертвований раскрывает мотивы получения прибыли». corpwatch.org.
- ^ «Мерк». Архивировано из оригинал 26 августа 2006 г.. Получено 30 августа 2006.
- ^ «Pfizer пожертвует флуконазол Южной Африке». Архивировано из оригинал 24 октября 2010 г.. Получено 30 августа 2006.
- ^ «Корпоративная ответственность: Новартис». novartis.com. Получено 19 мая 2016.
внешняя ссылка
 Котировки, связанные с Фармацевтическая индустрия в Викицитатнике
Котировки, связанные с Фармацевтическая индустрия в Викицитатнике- «Использование лекарств в мире в 2020 году». IMS Институт информатики здравоохранения. Ноябрь 2015 г.
- «Фармацевтическая промышленность и глобальное здравоохранение - факты и цифры, 2017» (PDF). Международная федерация фармацевтических производителей и ассоциаций. Февраль 2017 г.
- «Фармацевтическая промышленность в цифрах - ключевые данные за 2018 г.» (PDF). Европейская федерация фармацевтических предприятий и ассоциаций.

