WikiDer > Серин
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Серин | |||
| Другие имена 2-амино-3-гидроксипропановая кислота | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.250 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
PubChem CID | |||
| UNII |
| ||
| |||
| |||
| Свойства[2] | |||
| C3ЧАС7NО3 | |||
| Молярная масса | 105.093 г · моль−1 | ||
| Внешность | белые кристаллы или порошок | ||
| Плотность | 1,603 г / см3 (22 ° С) | ||
| Температура плавления | 246 ° С (475 ° F, 519 К) разлагается | ||
| растворимый | |||
| Кислотность (пKа) | 2,21 (карбоксил), 9,15 (амино)[1] | ||
| Страница дополнительных данных | |||
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |||
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ | ||
| УФ, ИК, ЯМР, РС | |||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
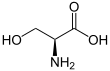
Серин (символ Сер или S)[3][4] это ɑ-аминокислота который используется в биосинтезе белков. Он содержит α-аминогруппа (который находится в протонированный −NH+
3 форма в биологических условиях), карбоксильная группа (который находится в депротонированный –COO−
образуются в биологических условиях), и боковая цепь, состоящая из гидроксиметил группа, классифицируя ее как полярный аминокислота. Он может синтезироваться в организме человека при нормальных физиологических условиях, что делает его незаменимой аминокислотой. Он закодирован кодоны UCU, UCC, UCA, UCG, AGU и AGC.
Вхождение
Это соединение является одним из встречающихся в природе протеиногенные аминокислоты. Только L-стереоизомер естественно появляется в белках. это не важно к рациону человека, так как синтезируется в организме из других метаболиты, в том числе глицин. Серин впервые был получен из шелк белок, особенно богатый источник, в 1865 году Эмилем Крамером.[5] Его название происходит от латинский для шелка, сыворотка. Структура Серина была основана в 1902 году.[6] Источники питания с высоким L-Серин, содержащийся в их белках, включает яйца, эдамаме, баранину, печень, свинину, лосось, сардины, водоросли, тофу.[7] [8]
Биосинтез
Биосинтез серина начинается с окисление из 3-фосфоглицерат (промежуточное звено от гликолиз) к 3-фосфогидроксипируват и НАДН от фосфоглицератдегидрогеназа (EC 1.1.1.95). Восстановительное аминирование (трансаминирование) этого кетона посредством фосфосерин трансаминаза (EC 2.6.1.52) дает 3-фосфосерин (О-фосфосерин), который гидролизуется до серина фосфосерин фосфатаза (EC 3.1.3.3).[9][10]
У бактерий, таких как Кишечная палочка эти ферменты кодируются генами serA (EC 1.1.1.95), serC (EC 2.6.1.52) и serB (EC 3.1.3.3).[11]
Биосинтез глицина: Серин гидроксиметилтрансфераза (SHMT = серинтрансгидроксиметилаза) также катализирует обратимые превращения L-серин к глицин (ретроальдольное расщепление) и 5,6,7,8-тетрагидрофолат к 5,10-метилентетрагидрофолат (mTHF) (гидролиз).[12] ШМТ - это пиридоксальфосфат (PLP) зависимый фермент. Глицин также может быть образован из CO2, NH4+, и mTHF в реакции, катализируемой глицинсинтаза.[9]
Синтез и промышленное производство
Промышленно, L-серин производится из глицина и метанола при катализе гидроксиметилтрансфераза.[13]
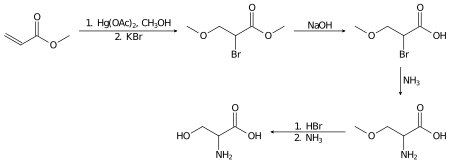
Рацемический серин можно получить в лаборатории из метилакрилат в несколько этапов:[14]
Биологическая функция
Метаболический

Серин важен в метаболизм в том, что он участвует в биосинтез из пурины и пиримидины. Это предшественник нескольких аминокислот, включая глицин и цистеин, а также триптофан в бактериях. Он также является предшественником многих других метаболитов, в том числе сфинголипиды и фолиевая кислота, который является основным донором одноуглеродных фрагментов в биосинтезе.
Структурная роль
Серин играет важную роль в каталитической функции многих ферменты. Было показано, что это происходит на активных сайтах химотрипсин, трипсин, и многие другие ферменты. Так называемое нервно-паралитические газы и многие вещества, используемые в инсектициды было показано, что они действуют путем объединения с остатком серина в активном центре ацетилхолинэстераза, полностью подавляя фермент.
Сериновые боковые цепи часто связаны водородными связями; наиболее часто образуются мелкие мотивы ST повороты, Мотивы ST (часто в начале альфа-спиралей) и Скобы ST (обычно в середине альфа-спиралей).
Являясь составной частью (остатком) белков, его боковая цепь может пройти О-связанное гликозилирование, который может быть функционально связан с[требуется разъяснение] сахарный диабет.
Это один из трех аминокислотных остатков, которые обычно фосфорилированный от киназы в течение клеточная сигнализация в эукариоты. Остатки фосфорилированного серина часто называют фосфосерин.
Сериновые протеазы являются распространенным типом протеаз.
Сигнализация
D-Серин, синтезируемый в нейронах серин рацемаза от L-серин (его энантиомер), служит нейромодулятором, коактивируя Рецепторы NMDA, позволяя им открываться, если они затем связывают глутамат. D-серин - сильнодействующий агонист на глицин сайт (NR1) Рецептор глутамата NMDA-типа (NMDAR). Для открытия рецептора глутамат и либо глицин, либо D-серин должен связываться с ним; кроме того, нельзя связывать блокатор пор (например, Mg2+ или Zn2+).[15] По факту, D-серин является более сильным агонистом на сайте глицина на NMDAR, чем сам глицин.
D- до относительно недавнего времени считалось, что серин существует только у бактерий; это был второй D аминокислота, обнаруженная в природе в организме человека и присутствующая в качестве сигнальной молекулы в головном мозге, вскоре после открытия D-аспартат. Было D аминокислоты были обнаружены у людей раньше, сайт глицина на рецепторе NMDA можно было бы вместо этого назвать D-серин сайт.[16] Помимо центральной нервной системы, D-серин играет сигнальную роль в периферических тканях и органах, таких как хрящи,[17] почка[18] и кавернозное тело.[19]
Вкусовые ощущения
L-Серин сладкий с минором умами и кислый вкус при высокой концентрации.
Чистый D-серин - это не совсем белый кристаллический порошок с очень слабым затхлым ароматом. D-Серин сладкий с добавлением небольшой кислинки при средних и высоких концентрациях.[20]
Клиническое значение
Расстройства, связанные с недостаточностью серина, представляют собой редкие дефекты биосинтеза аминокислоты. L-серин. В настоящее время зарегистрированы три нарушения: дефицит 3-фосфоглицератдегидрогеназы, дефицит 3-фосфосеринфосфатазы и дефицит фосфосерин-аминотрансферазы. Эти дефекты ферментов приводят к тяжелым неврологическим симптомам, таким как врожденная микроцефалия и тяжелая психомоторная отсталость, а у пациентов с дефицитом 3-фосфоглицератдегидрогеназы, кроме того, к трудноизлечимым приступам. Эти симптомы в различной степени поддаются лечению L-серин, иногда в сочетании с глицином.[21][22]Ответ на лечение варьируется, а долгосрочные и функциональные результаты неизвестны. Чтобы обеспечить основу для улучшения понимания эпидемиологии, корреляции генотипа / фенотипа и исхода этих заболеваний, их влияния на качество жизни пациентов, а также для оценки диагностических и терапевтических стратегий, некоммерческой организацией был создан реестр пациентов. Международная рабочая группа по заболеваниям, связанным с нейротрансмиттерами (iNTD).[23]
Исследования для терапевтического использования
Классификация L-серин, как незаменимая аминокислота, стал рассматриваться как условный, поскольку позвоночные животные, такие как люди, не всегда могут синтезировать оптимальные количества в течение всей продолжительности жизни.[24] L-серин проходит одобренные FDA клинические испытания на людях в качестве возможного средства лечения бокового амиотрофического склероза, ALS (Идентификатор ClinicalTrials.gov: NCT01835782).[25] Мета-анализ 2011 года обнаружил дополнительные саркозин иметь средний эффект для негативных и общих симптомов.[26] Также есть свидетельства того, что L-Серин может играть терапевтическую роль при диабете.[27]
D-Серин изучается на грызунах как потенциальное средство от шизофрении.[28] D-Серин также был описан как потенциальный биомаркер раннего Болезнь Альцгеймера (AD) диагноз из-за относительно высокой концентрации его в спинномозговая жидкость вероятных больных БА.[29].
Смотрите также
- Изосерин
- Гомосерин (изотреонин)
- Кластер октамера серина
использованная литература
- ^ Доусон, R.M.C. и др., Данные для биохимических исследований, Oxford, Clarendon Press, 1959.
- ^ Weast RC, изд. (1981). CRC Справочник по химии и физике (62-е изд.). Бока-Ратон, Флорида: CRC Press. п. С-512. ISBN 0-8493-0462-8.
- ^ «Номенклатура и символика аминокислот и пептидов». Совместная комиссия IUPAC-IUB по биохимической номенклатуре. 1983 г. В архиве из оригинала от 9 октября 2008 г.. Получено 5 марта 2018.
- ^ «Номенклатура и символика аминокислот и пептидов (Рекомендации IUPAC-IUB 1983 г.)», Pure Appl. Chem., 56 (5): 595–624, 1984, Дои:10.1351 / pac198456050595.
- ^ "Ueber die Bestandtheile der Seide". Journal für praktische Chemie 96.
- ^ «Серин». Колумбийская энциклопедия, 6-е изд.. encyclopedia.com. Получено 22 октября 2012.
- ^ Веб-сайт лаборатории химии мозга
- ^ Веб-сайт Self Nutrition Data
- ^ а б Страйер Л. (1988). Биохимия (3-е изд.). Нью-Йорк: W.H. Фримен. п.580. ISBN 978-0-7167-1843-7.
- ^ КЕГГ EC 3.1.3.3 и т.п.
- ^ Uniprot: серб
- ^ Ленингер А.Л., Нельсон Д.Л., Кокс М.М. (2000). Принципы биохимии (3-е изд.). Нью-Йорк: У. Х. Фриман. ISBN 1-57259-153-6.
- ^ Карлхайнц Драуз, Ян Грейсон, Аксель Клеманн, Ханс-Петер Криммер, Вольфганг Лойхтенбергер, Кристоф Векбеккер (2006). Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a02_057.pub2.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Картер Х., Запад HD (1940). "дл-Серин ». Орг. Synth. 20: 81. Дои:10.15227 / orgsyn.020.0081.
- ^ Лю Ю., Хилл Р., Архем П., фон Эйлер Г. (2001). «NMDA и глицин регулируют аффинность сайта Mg2 + -блока в каналах рецепторов NR1-1a / NR2A NMDA, экспрессируемых в ооцитах Xenopus». Науки о жизни. 68 (16): 1817–26. Дои:10.1016 / S0024-3205 (01) 00975-4. PMID 11292060.
- ^ Mothet JP, Parent AT, Wolosker H, Brady RO, Linden DJ, Ferris CD, Rogawski MA, Snyder SH (апрель 2000 г.). «D-серин является эндогенным лигандом для сайта глицина рецептора N-метил-D-аспартата». Труды Национальной академии наук Соединенных Штатов Америки. 97 (9): 4926–31. Bibcode:2000PNAS ... 97.4926M. Дои:10.1073 / пнас.97.9.4926. ЧВК 18334. PMID 10781100.
- ^ Такарада Т., Хинои Э, Такахата Й, Йонеда Й (май 2008 г.). «Серинрацемаза подавляет хондрогенную дифференцировку в хрящах Sox9-зависимым образом». Журнал клеточной физиологии. 215 (2): 320–8. Дои:10.1002 / jcp.21310. PMID 17929246.
- ^ Ма MC, Хуанг Х.С., Чен Ю.С., Ли Ш. (ноябрь 2008 г.). «Механочувствительные рецепторы N-метил-D-аспартата способствуют сенсорной активации в почечной лоханке крыс». Гипертония. 52 (5): 938–44. Дои:10.1161 / ГИПЕРТЕНЗИЯAHA.108.114116. PMID 18809793.
- ^ Гасеми М., Резания Ф., Левин Дж., Мур К.П., Мани А.Р. (июнь 2010 г.). «d-серин модулирует нейрогенное расслабление кавернозного тела крысы». Биохимическая фармакология. 79 (12): 1791–6. Дои:10.1016 / j.bcp.2010.02.007. PMID 20170643.
- ^ Кавай М., Секине-Хаякава Ю., Окияма А., Ниномия Ю. (декабрь 2012 г.). «Вкусовые ощущения от (L) - и (D) -аминокислот у человека». Аминокислоты. 43 (6): 2349–58. Дои:10.1007 / s00726-012-1315-х. PMID 22588481.
- ^ де Конинг Т.Дж. (апрель 2006 г.). «Лечение аминокислотами при нарушениях дефицита серина». Журнал наследственных метаболических заболеваний. 29 (2): 347–351. Дои:10.1007 / s10545-006-0269-0. PMID 16763900.
- ^ Tabatabaie L; Klomp LW; Berger R; де Конинг Т.Дж. (март 2010 г.). «Синтез L-серина в центральной нервной системе: обзор нарушений дефицита серина». Мол Генет Метаб. 99 (3): 256–262. Дои:10.1016 / j.ymgme.2009.10.012. PMID 19963421.
- ^ «Регистр пациентов».
- ^ Metcalf, J. S .; Dunlop, R.A .; Powell, J. T .; Banack, S.A .; Кокс, П. А. (2017). «L-серин: встречающаяся в природе аминокислота с терапевтическим потенциалом». Исследования нейротоксичности. 33 (1): 213–221. Дои:10.1007 / s12640-017-9814-х. ISSN 1029-8428.
- ^ Данлоп Р.А., Кокс П.А., Банак С.А., Роджерс К.Дж. «Небелковая аминокислота BMAA неправильно инкорпорирована в человеческие белки вместо L-серина, вызывая неправильную укладку и агрегацию белка». PLOS ONE. 8 (9): e75376. Bibcode:2013PLoSO ... 875376D. Дои:10.1371 / journal.pone.0075376. ЧВК 3783393. PMID 24086518.
- ^ Сингх С.П., Сингх В. (октябрь 2011 г.). «Мета-анализ эффективности дополнительных модуляторов рецепторов NMDA при хронической шизофрении». Препараты ЦНС. 25 (10): 859–85. Дои:10.2165/11586650-000000000-00000. PMID 21936588.
- ^ Holm, Laurits J .; Бушард, Карстен (2019). «L-серин: аминокислота, которой пренебрегают, с потенциальной терапевтической ролью при диабете». APMIS. Дои:10.1111 / apm.12987. ISSN 0903-4641.
- ^ Balu DT, Li Y, Puhl MD, Benneyworth MA, Basu AC, Takagi S, Bolshakov VY, Coyle JT (июнь 2013 г.). «Множественные пути риска для шизофрении сходятся у мышей с нокаутом серинрацемазы, мышиная модель гипофункции рецептора NMDA». Труды Национальной академии наук Соединенных Штатов Америки. 110 (26): E2400-9. Bibcode:2013PNAS..110E2400B. Дои:10.1073 / пнас.1304308110. ЧВК 3696825. PMID 23729812.
- ^ Мадейра С., Лоуренко М.В., Варгас-Лопес С., Суэмото С.К., Брандао CO, Рейс Т., Лейте Р.Э., Лакс Дж., Якоб-Филью В., Паскуалуччи К.А., Гринберг Л.Т., Феррейра С.Т., Паниццутти Р. (5 мая 2015 г.). «Уровни d-серина при болезни Альцгеймера: значение для разработки новых биомаркеров». Трансляционная психиатрия. 5 (5): e561. Дои:10.1038 / tp.2015.52. ЧВК 4471283. PMID 25942042.