WikiDer > Этинилэстрадиол - Википедия
 | |
 | |
| Клинические данные | |
|---|---|
| Произношение | /ˌɛθɪпɪлˌɛsтрəˈdаɪ.əl/ |
| Торговые наименования | Многочисленные |
| Другие имена | Этинилэстрадиол; Этинилэстрадиол; Этинилэстрадиол; EE; EE2; 17α-этинилэстрадиол; 17α-этинилестра-1,3,5 (10) -триен-3,17β-диол; NSC-10973[1] |
| AHFS/Drugs.com | Международные названия лекарств |
| MedlinePlus | a604032 |
| Данные лицензии | |
| Беременность категория | |
| Маршруты администрация | • Устно (планшет) • Трансдермальный (пластырь) • Вагинальный (звенеть) |
| Класс препарата | Эстроген |
| Код УВД | |
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетический данные | |
| Биодоступность | 38–48%[2][3][4] |
| Связывание с белками | 97–98% (до альбумин;[5] не привязан к SHBG)[6] |
| Метаболизм | Печень (в первую очередь CYP3A4)[9] |
| Метаболиты | • Сульфат этинилэстрадиола[7][8] • Другое[7][8] |
| Устранение период полураспада | 7–36 часов[9][2][10][11] |
| Экскреция | Кал: 62%[10] Моча: 38%[10] |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.000.311 |
| Химические и физические данные | |
| Формула | C20ЧАС24О2 |
| Молярная масса | 296.410 г · моль−1 |
| 3D модель (JSmol) | |
| Температура плавления | От 182 до 184 ° C (от 360 до 363 ° F) |
| |
| |
| (проверять) | |
Этинилэстрадиол (EE) является эстроген лекарство, которое широко используется в противозачаточные таблетки в комбинации с прогестины.[7][8] В прошлом ЭЭ широко использовалась по различным показаниям, например, для лечения менопаузальный симптомы, гинекологические расстройства, и некоторые гормоночувствительный рак. Обычно берется устно но также используется как пластырь и вагинальное кольцо.[7][12]
Генерал побочные эффекты ЭЭ включают болезненность молочных желез и увеличение, Головная боль, задержка жидкости, и тошнота среди прочего.[7] У мужчин ЭЭ может дополнительно вызывать развитие груди, феминизация в целом, гипогонадизм, и сексуальная дисфункция. Редкие, но серьезные побочные эффекты включают: сгустки крови, повреждение печени, и рак матки.[7]
EE - это эстроген, или агонист из рецепторы эстрогена, то биологическая мишень эстрогенов, таких как эстрадиол.[7] Это синтетический производная из эстрадиол, а естественный эстроген, и отличается от него различными способами.[7] По сравнению с эстрадиолом, ЭЭ значительно улучшился. биодоступность при приеме внутрь более устойчив к метаболизм, и показывает относительно повышенное воздействие на определенные части тела, такие как печень и матка.[7] Эти различия делают ЭЭ более подходящим для использования в противозачаточных таблетках, чем эстрадиол, хотя также приводят к повышенному риску образования тромбов и некоторым другим редким побочным эффектам.[7]
EE был разработан в 1930-х годах и был введен в медицинское использование в 1943 году.[13][14] Лекарство начали использовать в противозачаточных таблетках в 1960-х годах.[15] Сегодня ЭЭ встречается практически во всех комбинированный формы противозачаточных таблеток и является почти единственным эстрогеном, используемым для этой цели, что делает его одним из, если не самым широко используемым эстрогеном.[16][17]
Медицинское использование
EE имеет много применений. Чаще всего используется как контрацепция в комбинированные оральные контрацептивы (КОК), также известный как контроль рождаемости, чтобы предотвратить беременность после секса. EE в составе противозачаточных средств используется не только для предотвращения беременности, но также может использоваться для лечения отсутствия менструации, симптомов во время менструации и угревая сыпь.
EE также используется как менопаузальная гормональная терапия. Основной причиной использования ЗГТ у женщин в период менопаузы является облегчение общего вазомоторный такие симптомы, как приливы, ночная потливость и приливы. Исследования показали, что замена эстрогена помогает улучшить эти симптомы по сравнению с плацебо.[18] Другие распространенные симптомы менопаузы, такие как сухость влагалища (которая может вызывать боль во время полового акта), вагинальный зуд и подавленное настроение, могут получить пользу от ЗГТ. Помимо лечения симптомов менопаузы, ЭЭ использовался как компонент феминизирующая гормональная терапия за трансгендерные женщины.[19] Однако он больше не используется и не рекомендуется для этой цели. эстрадиол в значительной степени вытеснив его.[19]
ЭЭ также можно использовать для лечения гипогонадизм у женщин, предотвращает остеопороз у женщин и используется в качестве паллиативная помощь за рак простаты у мужчин и рак молочной железы у женщин.[8][20]
ЭЭ или любой эстроген противопоказан женщинам с маткой из-за повышенного риска рак эндометрия; давая прогестаген с эстрогеном снижает риск.[21]
Доступные формы
ЭЭ доступен в сочетании с прогестином в большом количестве КОК.[22] Он также доступен в сочетании с прогестинами в качестве трансдермальный противозачаточный пластырь и как контрацептивное вагинальное кольцо.[12] Кроме того, существует единственный препарат, содержащий очень низкие дозы ЭЭ (2,5 и 5 мкг) плюс прогестин для перорального приема. планшет который остается в использовании для гормональной терапии менопаузы.[12] EE ранее был доступен под торговой маркой Estinyl в форме таблеток 0,02, 0,05 и 0,5 мг (20, 50 и 500 мкг).[23]
Количество ЭЭ в КОК с годами снизилось.[8] Ранее КОК содержали высокие дозы ЭЭ - до 100 мкг / день.[24] Дозы более 50 мкг ЭЭ считаются высокими дозами, дозы 30 и 35 мкг ЭЭ считаются низкими, а дозы от 10 до 25 мкг ЭЭ считаются очень низкими дозами.[25] Сегодня КОК обычно содержат от 10 до 50 мкг ЭЭ.[25] Более высокие дозы ЭЭ были отменены из-за высокого риска ВТЭ и сердечно-сосудистых проблем.[24]
Противопоказания
ЭЭ следует избегать у лиц с историей или известной восприимчивостью к артериальный или же венозный тромбоз (сгустки крови), из-за повышенного риска сердечно-сосудистый такие проблемы как Венозная тромбоэмболия (ВТЕ), инфаркт миокарда, и ишемический приступ.[26] Сюда входят женщины с:
- История глубокие венозные тромбы (DVT) или легочная эмболия (PE) не получает антикоагулянты
- Острый ТГВ / ПЭ
- Длительная иммобилизация из-за серьезной операции
- Передовой сахарный диабет с сосудистым заболеванием
- Мигрень с аурой
- Гипертония ≥160/100
- Сосудистые заболевания
- Текущее и история ишемическая болезнь сердца
- Множественные факторы риска атеросклеротическое сердечно-сосудистое заболевание (например, пожилой возраст, курение, диабет, гипертония, низкий уровень ЛПВП, высокий уровень ЛПНП или высокий уровень триглицеридов)
- Возраст ≥35 и курение ≥15 сигарет в день
- История нарушение мозгового кровообращения
- Системный Красная волчанка с положительными (или неизвестными) антифосфолипидными антителами
- Сложно порок клапанов сердца
За исключением случаев, когда он используется для лечения, ЭЭ следует избегать у женщин с текущим рак молочной железы из-за возможного ухудшения прогноза.[27]
ЭЭ также следует избегать в кормление грудью женщины младше 21 дня послеродовой из-за повышенного риска ВТЭ.[28] Использование ЭЭ у кормящих женщин, срок послеродового периода которых составляет не менее 21 дня, следует обсудить с врачом и включить в него информацию о преимуществах, недостатках и альтернативах использования ЭЭ.[28]
Из-за риска холестатическая гепатотоксичность, широко считается, что КОК, содержащие ЭЭ, следует избегать женщинам с историей холестаз беременности, опухоли печени, активный гепатити семейные дефекты желчевыводящих путей.[29]
Побочные эффекты
| Доза этинилэстрадиола | Количество случаев ВТЭ | Женщина-лет | Скорость VTE | Скорректировано RRа |
|---|---|---|---|---|
| Низкий (<50 мкг) | 53 | 127,000 | 4,2 из 10 000 женщин-лет | 1.0 |
| Промежуточный (50 мкг) | 69 | 98,000 | 7,0 из 10 000 женщин-лет | 1.5 |
| Высокая (> 50 мкг) | 20 | 20,000 | 10,0 из 10 000 женщин-лет | 1.7 |
| Все | 142 | 245,000 | 5,8 на 10 000 женщин-лет | – |
| Сноски: а = Относительно низкой дозы (не к неиспользованию). Примечания: В противозачаточных таблетках, содержащих прогестин первого поколения, Такие как норэтистерон или же левоноргестрел. Источники: Главный: [30][31] Дополнительный: [32] | ||||
Выраженность побочных эффектов может варьироваться в зависимости от дозы и способа введения EE.[33] Общие побочные эффекты ЭЭ такие же, как и у других эстрогенов, и включают: болезненность молочных желез, Головная боль, задержка жидкости (вздутие живота), тошнота, головокружение, и увеличение веса.[10][29] Эстрогеновый компонент оральных контрацептивов, который почти всегда является ЭЭ, может вызывать болезненность молочных желез и полнота.[23] У мужчин ЭЭ имеет дополнительные побочные эффекты, в том числе: гинекомастия (развитие груди), феминизация в целом, гипогонадизм, бесплодие, и сексуальная дисфункция (например, сокращенный либидо и Эректильная дисфункция). У мужчин, получивших высокие дозы эстрогена При приеме 200 мкг / день перорального ЭЭ в течение более трех месяцев гинекомастия возникла у 98%, а снижение либидо - у 42-73%.[34]
Долгосрочные эффекты
Сгустки крови
VTE - это тромб в вена, и включает глубокие венозные тромбы (DVT) и легочная эмболия (ПЭ).[7][36][37] Известно, что эстрогены увеличивают риск ВТЭ из-за их воздействия на синтез печени из факторы коагуляции.[7][36][37] ЭЭ несет больший риск образования тромбов и ВТЭ, чем естественный эстрадиол, что, как полагают, связано с структурный различия между двумя соединениями и разная восприимчивость к печень инактивация.[7]
2012 год метаанализ подсчитал, что абсолютный риск ВТЭ составляет 2 на 10 000 женщин при неиспользовании, 8 на 10 000 женщин при ЭЭ и левоноргестрел-содержащие противозачаточные таблетки, и от 10 до 15 на 10 000 женщин для противозачаточных таблеток, содержащих ЭЭ и в третьих- или же прогестин четвертого поколения Такие как дезогестрел или же дроспиренон.[38] Для сравнения, абсолютный риск ВТЭ обычно оценивается от 1 до 5 на 10 000 женщин в год для неиспользования, от 5 до 20 на 10 000 женщин в год для беременности и от 40 до 65 на 10 000 женщин в год для беременных. послеродовой период.[38] Современные КОК связаны с риском ВТЭ примерно в 2–4 раза выше, чем при неиспользовании.[38] В путь введения ЭЭ не влияет на риск ВТЭ, так как ЭЭ / прогестинсодержащие противозачаточные вагинальные кольца и противозачаточные пластыри имеют такой же или даже более высокий риск ВТЭ, чем КОК.[38][39] При беременности риск ВТЭ увеличивается примерно в 4,3 раза.[38] Было подсчитано, что по крайней мере от 300 до 400 здоровых молодых женщин умирают каждый год в США из-за ВТЭ, вызванного противозачаточными таблетками, содержащими ЭЭ.[40]
Современные КОК содержат от 10 до 35 мкг ЭЭ, но обычно 20, 30 или 35 мкг.[38][41] Первоначальные составы КОК, представленные в 1960-х годах, содержали от 100 до 150 мкг ЭЭ.[42][32][41] Однако вскоре было обнаружено, что ЭЭ ассоциируется с повышенным риском ВТЭ и что этот риск зависит от дозы.[41] После этих событий доза ЭЭ была значительно снижена и теперь всегда составляет менее 50 мкг.[43][44][45] Эти более низкие дозы значительно снижают риск ВТЭ без потери противозачаточной эффективности.[41] Герстман и др. (1991) обнаружили, что КОК, содержащие более 50 мкг ЭЭ, в 1,7 раза, а КОК, содержащие 50 мкг ЭЭ, в 1,5 раза превышают риск ВТЭ для КОК, содержащих менее 50 мкг.[30] 2014 год Кокрейн Обзор показал, что КОК, содержащие 50 мкг ЭЭ с левоноргестрелом, имели в 2,1–2,3 раза больше риска для КОК, содержащих 30 мкг или 20 мкг ЭЭ с левоноргестрелом, соответственно.[38] КОК, содержащие 20 мкг ЭЭ, также связаны со значительно меньшим риском сердечно-сосудистых событий, чем КОК, содержащие 30 или 40 мкг ЭЭ.[46] Однако прекращение приема КОК чаще встречается при дозах ЭЭ от 10 до 20 мкг из-за проблемных изменений характера кровотечений.[47]
Женщины с тромбофилия риск ВТЭ при использовании противозачаточных средств, содержащих ЭЭ, значительно выше, чем у женщин без тромбофилии.[38][39] В зависимости от состояния, риск ВТЭ может быть увеличен в 5-50 раз по сравнению с неиспользованием у таких женщин.[38][39]
Глобулин, связывающий половые гормоны (SHBG) уровни указывают на воздействие эстрогенов в печени и могут быть суррогатный маркер за коагуляция и риск ВТЭ при терапии эстрогенами, хотя эта тема обсуждалась.[48][49][50] Уровень ГСПГ при приеме противозачаточных таблеток, содержащих различные прогестины, увеличивается в 1,5–2 раза при приеме левоноргестрел, От 2,5 до 4 раз с дезогестрел и гестоден, От 3,5 до 4 раз с дроспиренон и диеногест, и от 4 до 5 раз с ципротерона ацетат.[48] Противозачаточные вагинальные кольца и противозачаточные пластыри аналогично было обнаружено, что уровень SHBG повышается в 2,5 и 3,5 раза соответственно.[48] Противозачаточные таблетки, содержащие высокие дозы этинилэстрадиола (> 50 мкг), могут повышать уровень ГСПГ в 5-10 раз, что аналогично увеличению, которое происходит во время беременности.[51] И наоборот, увеличение уровней SHBG намного ниже при эстрадиол, особенно при парентеральном применении.[52][53][54][55][56] Парентерально в высоких дозах фосфат полиэстрадиола Было обнаружено, что терапия увеличивает уровень SHBG примерно в 1,5 раза.[55]
| Тип | Маршрут | Лекарства | Соотношение шансов (95% CI) |
|---|---|---|---|
| Менопаузальная гормональная терапия | Устный | Эстрадиол один ≤1 мг / день > 1 мг / день | 1.27 (1.16–1.39)* 1.22 (1.09–1.37)* 1.35 (1.18–1.55)* |
| Конъюгированные эстрогены один ≤0,625 мг / день > 0,625 мг / день | 1.49 (1.39–1.60)* 1.40 (1.28–1.53)* 1.71 (1.51–1.93)* | ||
| Эстрадиол / медроксипрогестерона ацетат | 1.44 (1.09–1.89)* | ||
| Эстрадиол / дидрогестерон ≤1 мг / день E2 > 1 мг / день E2 | 1.18 (0.98–1.42) 1.12 (0.90–1.40) 1.34 (0.94–1.90) | ||
| Эстрадиол / норэтистерон ≤1 мг / день E2 > 1 мг / день E2 | 1.68 (1.57–1.80)* 1.38 (1.23–1.56)* 1.84 (1.69–2.00)* | ||
| Эстрадиол / норгестрел или же эстрадиол / дроспиренон | 1.42 (1.00–2.03) | ||
| Конъюгированные эстрогены / медроксипрогестерона ацетат | 2.10 (1.92–2.31)* | ||
| Конъюгированные эстрогены / норгестрел ≤0,625 мг / день ЦВЕ > 0,625 мг / день ЦВЕ | 1.73 (1.57–1.91)* 1.53 (1.36–1.72)* 2.38 (1.99–2.85)* | ||
| Тиболон один | 1.02 (0.90–1.15) | ||
| Ралоксифен один | 1.49 (1.24–1.79)* | ||
| Трансдермальный | Эстрадиол один ≤50 мкг / день > 50 мкг / день | 0.96 (0.88–1.04) 0.94 (0.85–1.03) 1.05 (0.88–1.24) | |
| Эстрадиол/прогестаген | 0.88 (0.73–1.01) | ||
| Вагинальный | Эстрадиол один | 0.84 (0.73–0.97) | |
| Конъюгированные эстрогены один | 1.04 (0.76–1.43) | ||
| Комбинированные противозачаточные средства | Устный | Этинилэстрадиол / норэтистерон | 2.56 (2.15–3.06)* |
| Этинилэстрадиол / левоноргестрел | 2.38 (2.18–2.59)* | ||
| Этинилэстрадиол / норгестимат | 2.53 (2.17–2.96)* | ||
| Этинилэстрадиол / дезогестрел | 4.28 (3.66–5.01)* | ||
| Этинилэстрадиол / гестоден | 3.64 (3.00–4.43)* | ||
| Этинилэстрадиол / дроспиренон | 4.12 (3.43–4.96)* | ||
| Этинилэстрадиол / ципротерона ацетат | 4.27 (3.57–5.11)* | ||
| Примечания: (1) Вложенные исследования случай – контроль (2015, 2019) по данным QResearch и Даталинк исследований клинической практики (CPRD) базы данных. (2) Биоидентичный прогестерон не был включен, но известно, что он не связан с дополнительным риском по сравнению с одним эстрогеном. Сноски: * = Статистически значимый (п < 0.01). Источники: См. Шаблон. | |||
Сердечно-сосудистые проблемы
При пероральном применении в высоких дозах, например, как форма терапии высокими дозами эстрогена у мужчин с раком простаты и у женщин с раком груди, синтетический и небиоидентичный эстрогены, такие как EE и диэтилстильбестрол связаны с довольно высокими показателями тяжелых сердечно-сосудистый такие осложнения, как ВТЭ, инфаркт миокарда, и Инсульт.[20][57][58] Диэтилстильбестрол связан с повышением риска сердечно-сосудистой токсичности и смерти до 35% и с 15% -ной частотой ВТЭ у мужчин, получавших его по поводу рака простаты.[57][58] ЭЭ имеет до некоторой степени меньший риск сердечно-сосудистый осложнений, чем диэтилстильбестрол при лечении рака простаты у мужчин.[8] Однако как ЭЭ, так и диэтилстильбестрол, тем не менее, оказывают очень непропорциональное воздействие на синтез белка в печени, который считается ответственным за их сердечно-сосудистую токсичность.[7][58]
В отличие от пероральных синтетических эстрогенов, таких как ЭЭ и диэтилстильбестрол, высокие дозировки фосфат полиэстрадиола и трансдермальный эстрадиол не увеличивает риск сердечно-сосудистых заболеваний. смертность или же тромбоэмболия у мужчин с раком простаты.[58][59][60] Однако значительно увеличилась сердечно-сосудистая болезненность наблюдалось при применении высоких доз полиэстрадиолфосфата.[58][59][60] В любом случае эти эстрогены считаются намного безопаснее, чем синтетические эстрогены для перорального применения, такие как ЭЭ и диэтилстильбестрол.[58][59][60] Кроме того, сульфонат этинилэстрадиола (EES), устное, но парентеральный-подобное пролекарство длительного действия EE, используется при лечении рака простаты и, как говорят, имеет значительно лучший профиль сердечно-сосудистой безопасности, чем EE.[8]
Из-за непропорционального воздействия на синтез белка в печени и связанных с ним сердечно-сосудистых рисков синтетические эстрогены, такие как ЭЭ и диэтилстильбестрол, больше не используются в гормональной терапии менопаузы.[8] Они также заменяются парентеральными формами эстрадиола, такими как фосфат полиэстрадиола и трансдермальный эстрадиол, при лечении рака простаты.[58]
Повреждение печени
ЭЭ редко (в низких дозировках, которые сейчас используются в КОК) были связаны с холестатический гепатотоксичность аналогично 17α-алкилированный андрогены/анаболические стероиды и 17α-этинилированный 19-нортестостерон прогестины.[61][62] Глюкуронид метаболиты ЭЭ через эффекты на ABCB11 (BSEP) и MRP2 (ABCC2) белки и последующие изменения в желчь поток и желчная соль выделение, по-видимому, ответственны за холестаз.[63] Высокие концентрации эстрадиола через его метаболит эстрадиол глюкуронид, также вовлечены в холестаз, например, в холестаз беременности.[62] Однако частота и тяжесть холестатической гепатотоксичности, по-видимому, намного выше у ЭЭ, чем у эстрадиола, что связано с его замещением на 17α-этинил и, как следствие, снижением метаболизма.[29]
Рак матки
Высокие дозы ЭЭ, которые использовались в ранних КОК, были связаны со значительно повышенным риском рак эндометрия в некоторых препаратах, например содержащих гестаген диметистерон.[64] Не встречавшиеся противодействия эстрогены, такие как EE, обладают канцерогенным действием на эндометрий, а прогестагены защищают от этих эффектов, но диметистерон является относительно слабым прогестагеном и не смог адекватно противодействовать канцерогенным эффектам EE на эндометрий, что, в свою очередь, привело к увеличению риска рака эндометрия.[64] С тех пор прием КОК, содержащих диметистерон, был прекращен (вместо них использовались более сильнодействующие гестагены), а дозы ЭЭ в КОК в целом были резко снижены, что исключило риск.[64] В свою очередь, большинство исследований современных КОК выявили снижение риска рака эндометрия.[65]
Экологические эффекты
Сточные Воды содержит различные эстрогены, включая ЭЭ, которые не полностью расщепляются процедуры очистки сточных вод.[66] Поступление искусственных эстрогенов в пресная вода экосистемы влияют рыбы и амфибия населения. Хроническое воздействие низких уровней ЭЭ в течение семи лет привело к коллапсу толстоголовый пескарь населения в экспериментальное озеро в Онтарио, Канада.[66] EE изменено оогенез у самок рыб и феминизированных самцов, так что они продуцировали белок, связанный с созреванием яйца вителлогенин, а также яйца на ранних стадиях.[66] У амфибий воздействие ЭЭ может снизить успешность вылупления и изменить развитие гонад.[67] Воздействие гормонов может изменить развитие гонад у лягушек, даже если оно закодированный в их гены.[67] Исследование норковые лягушки нашел больше интерсекс головастики у тех, кто экспериментально подвергался ЭЭ, чем у тех, кто не подвергался ЭЭ, и зеленые лягушки показали гораздо более низкие показатели успешности вылупления.[67]
Передозировка
Эстрогены, такие как ЭЭ, относительно безопасны при остром передозировка.[нужна цитата]
Взаимодействия
ЭЭ метаболизируется определенными цитохром P450 изоформы, в том числе CYP3A4 и CYP2C9.[68] Таким образом, индукторы ферментов, таких как CYP3A4, могут снизить концентрацию ЭЭ в крови.[29] Примеры индукторов включают: противосудорожные препараты подобно фенитоин, примидон, этосуксимид, фенобарбитал, и карбамазепин; азол противогрибковые подобно флуконазол; и рифамицин антибиотики подобно рифампицин (рифампицин).[29] И наоборот, ингибиторы CYP3A4 и других ферментов цитохрома P450 могут увеличивать циркулирующие уровни EE.[29] Примером является тролеандомицин, который является мощным и высокоселективным ингибитором CYP3A4.[29]
Парацетамол (ацетаминофен) был обнаружен конкурентно подавлять сульфатирование EE с предварительной обработкой 1000 мг парацетамола значительно увеличивает AUC уровни EE (на 22%) и снижение уровня AUC сульфат этинилэстрадиола (Сульфат ЭЭ) у женщин.[29] То же самое было обнаружено для аскорбиновая кислота (витамин C) и EE, хотя значение взаимодействия было расценено как сомнительное.[29]
В отличие от эстрадиола маловероятно, что существует фармакокинетическое взаимодействие между курение (что потенциально вызывает определенные цитохром P450 ферменты и заметно увеличивает 2-гидроксилирование эстрадиола) и ЭЭ.[29] Это говорит о том, что эстрадиол и EE метаболизируются различными ферментами цитохрома P450.[29] Однако существует повышенный риск сердечно-сосудистых осложнений при курении и ЭЭ, как и в случае курения и других эстрогенов.[29]
EE известно подавлять несколько цитохром P450 ферменты, в том числе CYP1A2, CYP2B6, CYP2C9, CYP2C19, и CYP3A4, и, возможно, индуктор из CYP2A6.[69] В результате это может повлиять на метаболизм и концентрацию многих других лекарств.[69] Примеры известных взаимодействий включают: бупропион, кофеин, мефенитоин, мидазолам, никотин, нифедипин, омепразол, пропранолол, прогуанил, селегилин, теофиллин, и тизанидин.[69][29] Одним из наиболее заметных взаимодействий является то, что ЭЭ сильно увеличивает уровни селегилин, субстрат CYP2B6 и CYP2C19.[69] ЭЭ может также вызвать глюкуронизация и, возможно, изменить сульфатирование.[69] Было обнаружено, что он увеличивает клиренс и снижает концентрацию различных препаратов, которые, как известно, глюкуронидируются.[69] Примеры включают клофибрат, ламотриджин, лоразепам, оксазепам, и пропранолол.[69]
Прогестины, которые часто используются в сочетании с EE, также известны как ингибирующие ферменты цитохрома P450, и это также может способствовать лекарственному взаимодействию с EE-содержащими контрацептивами.[69] Примеры включают гестоден, дезогестрел, и этоногестрел, которые являются ингибиторами CYP3A4 и CYP2C19.[69] Кроме того, известно, что эти прогестины прогрессивно ингибируют метаболизм и повышают концентрацию самого EE.[29]
Фармакология
Фармакодинамика
EE - это эстроген аналогично натуральным эстрогенам, таким как эстрадиол и конъюгированные эстрогены (Премарин) и синтетические эстрогены, такие как диэтилстильбестрол. Он связывает и активирует оба изоформы из рецептор эстрогена, ERα и ERβ.[8] В одном исследовании было обнаружено, что EE имеет 233% и 38% близость из эстрадиол для ERα и ERβ соответственно.[70] В другом исследовании было обнаружено, что он обладает 194% и 151% сродства эстрадиола к ERα и ERβ соответственно.[71] ЭЭ также действует как мощный агонист G-протеиновый рецептор эстрогена (GPER) (родство неизвестно), a мембранный рецептор эстрогена, аналогично эстрадиолу.[72][73][74][75] Эстрогены имеют антигонадотропный эффекты через активацию ERα.[76] В качестве противозачаточного средства ЭЭ действует совместно с прогестином, подавляя всплеск в середине цикла. лютеинизирующий гормон (LH) и фолликулостимулирующего гормона (ФСГ) за счет его антигонадотропного действия, тем самым подавляя фолликулогенез и предотвращение овуляция и, следовательно, возможность беременность.[77][78]
EE - это эстроген длительного действия с задержкой в ядре около 24 часов.[31]
При пероральном приеме ЭЭ примерно в 100 раз мощнее натуральных эстрогенов, таких как микронизированный эстрадиол и конъюгированных эстрогенов, что во многом связано с более высокой устойчивостью к метаболизм первого прохождения.[79][80][81] В частности, он в 80-200 раз мощнее, чем эстропипат (пиперазинэстрона сульфат), который имеет активность, аналогичную микронизированному эстрадиолу, с точки зрения системной эстрогенной активности.[82][83] Напротив, эффективность ЭЭ и природных эстрогенов при их введении схожа. внутривенно, из-за обхода метаболизма первого прохождения.[41] Относительно своего пролекарство местранол, EE примерно в 1,7 раза эффективнее при пероральном приеме.[80]
| Лиганд | Другие имена | Относительное сродство связывания (РБА,%)а | Абсолютное связывающее сродство (Kя, нМ)а | Действие | ||
|---|---|---|---|---|---|---|
| ERα | ERβ | ERα | ERβ | |||
| Эстрадиол | E2; 17β-эстрадиол | 100 | 100 | 0.115 (0.04–0.24) | 0.15 (0.10–2.08) | Эстроген |
| Estrone | E1; 17-кетоэстрадиол | 16.39 (0.7–60) | 6.5 (1.36–52) | 0.445 (0.3–1.01) | 1.75 (0.35–9.24) | Эстроген |
| Эстриол | E3; 16α-OH-17β-E2 | 12.65 (4.03–56) | 26 (14.0–44.6) | 0.45 (0.35–1.4) | 0.7 (0.63–0.7) | Эстроген |
| Эстетрол | E4; 15α, 16α-Di-OH-17β-E2 | 4.0 | 3.0 | 4.9 | 19 | Эстроген |
| Альфатрадиол | 17α-эстрадиол | 20.5 (7–80.1) | 8.195 (2–42) | 0.2–0.52 | 0.43–1.2 | Метаболит |
| 16-эпиестриол | 16β-гидрокси-17β-эстрадиол | 7.795 (4.94–63) | 50 | ? | ? | Метаболит |
| 17-эпиестриол | 16α-гидрокси-17α-эстрадиол | 55.45 (29–103) | 79–80 | ? | ? | Метаболит |
| 16,17-эпиестриол | 16β-гидрокси-17α-эстрадиол | 1.0 | 13 | ? | ? | Метаболит |
| 2-гидроксиэстрадиол | 2-ОН-E2 | 22 (7–81) | 11–35 | 2.5 | 1.3 | Метаболит |
| 2-метоксиэстрадиол | 2-MeO-E2 | 0.0027–2.0 | 1.0 | ? | ? | Метаболит |
| 4-гидроксиэстрадиол | 4-ОН-E2 | 13 (8–70) | 7–56 | 1.0 | 1.9 | Метаболит |
| 4-метоксиэстрадиол | 4-MeO-E2 | 2.0 | 1.0 | ? | ? | Метаболит |
| 2-гидроксиэстрон | 2-ОН-E1 | 2.0–4.0 | 0.2–0.4 | ? | ? | Метаболит |
| 2-метоксиэстрон | 2-MeO-E1 | <0.001–<1 | <1 | ? | ? | Метаболит |
| 4-гидроксиэстрон | 4-ОН-E1 | 1.0–2.0 | 1.0 | ? | ? | Метаболит |
| 4-метоксиэстрон | 4-MeO-E1 | <1 | <1 | ? | ? | Метаболит |
| 16α-гидроксиэстрон | 16α-OH-E1; 17-кетоэстриол | 2.0–6.5 | 35 | ? | ? | Метаболит |
| 2-гидроксиэстриол | 2-ОН-E3 | 2.0 | 1.0 | ? | ? | Метаболит |
| 4-метоксиэстриол | 4-MeO-E3 | 1.0 | 1.0 | ? | ? | Метаболит |
| Эстрадиола сульфат | E2S; Эстрадиол 3-сульфат | <1 | <1 | ? | ? | Метаболит |
| Дисульфат эстрадиола | Эстрадиол 3,17β-дисульфат | 0.0004 | ? | ? | ? | Метаболит |
| Эстрадиол 3-глюкуронид | E2-3G | 0.0079 | ? | ? | ? | Метаболит |
| Эстрадиол 17β-глюкуронид | E2-17G | 0.0015 | ? | ? | ? | Метаболит |
| Эстрадиол 3-глюк. 17β-сульфат | Э2-3Г-17С | 0.0001 | ? | ? | ? | Метаболит |
| Эстрона сульфат | E1S; Эстрон 3-сульфат | <1 | <1 | >10 | >10 | Метаболит |
| Бензоат эстрадиола | EB; Эстрадиол 3-бензоат | 10 | ? | ? | ? | Эстроген |
| Эстрадиол 17β-бензоат | E2-17B | 11.3 | 32.6 | ? | ? | Эстроген |
| Эстрон метиловый эфир | Эстрон 3-метиловый эфир | 0.145 | ? | ? | ? | Эстроген |
| Ent-Эстрадиол | 1-эстрадиол | 1.31–12.34 | 9.44–80.07 | ? | ? | Эстроген |
| Equilin | 7-дегидроэстрон | 13 (4.0–28.9) | 13.0–49 | 0.79 | 0.36 | Эстроген |
| Эквиленин | 6,8-дидегидроэстрон | 2.0–15 | 7.0–20 | 0.64 | 0.62 | Эстроген |
| 17β-дигидроэкилин | 7-дегидро-17β-эстрадиол | 7.9–113 | 7.9–108 | 0.09 | 0.17 | Эстроген |
| 17α-дигидроэкилин | 7-дегидро-17α-эстрадиол | 18.6 (18–41) | 14–32 | 0.24 | 0.57 | Эстроген |
| 17β-дигидроэквиленин | 6,8-дидегидро-17β-эстрадиол | 35–68 | 90–100 | 0.15 | 0.20 | Эстроген |
| 17α-дигидроэквиленин | 6,8-дидегидро-17α-эстрадиол | 20 | 49 | 0.50 | 0.37 | Эстроген |
| Δ8-Эстрадиол | 8,9-дегидро-17β-эстрадиол | 68 | 72 | 0.15 | 0.25 | Эстроген |
| Δ8-Эстроне | 8,9-дегидроэстрон | 19 | 32 | 0.52 | 0.57 | Эстроген |
| Этинилэстрадиол | EE; 17α-Этинил-17β-E2 | 120.9 (68.8–480) | 44.4 (2.0–144) | 0.02–0.05 | 0.29–0.81 | Эстроген |
| Местранол | EE 3-метиловый эфир | ? | 2.5 | ? | ? | Эстроген |
| Моксестрол | RU-2858; 11β-метокси-EE | 35–43 | 5–20 | 0.5 | 2.6 | Эстроген |
| Метилэстрадиол | 17α-метил-17β-эстрадиол | 70 | 44 | ? | ? | Эстроген |
| Диэтилстильбестрол | DES; Стилбестрол | 129.5 (89.1–468) | 219.63 (61.2–295) | 0.04 | 0.05 | Эстроген |
| Гексэстрол | Дигидродиэтилстильбестрол | 153.6 (31–302) | 60–234 | 0.06 | 0.06 | Эстроген |
| Диенестрол | Дегидростильбестрол | 37 (20.4–223) | 56–404 | 0.05 | 0.03 | Эстроген |
| Бензэстрол (B2) | – | 114 | ? | ? | ? | Эстроген |
| Хлортрианизен | ТАСЕ | 1.74 | ? | 15.30 | ? | Эстроген |
| Трифенилэтилен | TPE | 0.074 | ? | ? | ? | Эстроген |
| Трифенилбромэтилен | TPBE | 2.69 | ? | ? | ? | Эстроген |
| Тамоксифен | ICI-46,474 | 3 (0.1–47) | 3.33 (0.28–6) | 3.4–9.69 | 2.5 | SERM |
| Афимоксифен | 4-гидрокситамоксифен; 4-ОНТ | 100.1 (1.7–257) | 10 (0.98–339) | 2.3 (0.1–3.61) | 0.04–4.8 | SERM |
| Торемифен | 4-хлоротамоксифен; 4-CT | ? | ? | 7.14–20.3 | 15.4 | SERM |
| Кломифен | РСЗО-41 | 25 (19.2–37.2) | 12 | 0.9 | 1.2 | SERM |
| Циклофенил | F-6066; Сексовид | 151–152 | 243 | ? | ? | SERM |
| Наоксидин | U-11,000A | 30.9–44 | 16 | 0.3 | 0.8 | SERM |
| Ралоксифен | – | 41.2 (7.8–69) | 5.34 (0.54–16) | 0.188–0.52 | 20.2 | SERM |
| Арзоксифен | LY-353,381 | ? | ? | 0.179 | ? | SERM |
| Ласофоксифен | CP-336,156 | 10.2–166 | 19.0 | 0.229 | ? | SERM |
| Ормелоксифен | Centchroman | ? | ? | 0.313 | ? | SERM |
| Левормелоксифен | 6720-CDRI; NNC-460 020 | 1.55 | 1.88 | ? | ? | SERM |
| Оспемифен | Deaminohydroxytoremifene | 2.63 | 1.22 | ? | ? | SERM |
| Базедоксифен | – | ? | ? | 0.053 | ? | SERM |
| Etacstil | GW-5638 | 4.30 | 11.5 | ? | ? | SERM |
| ICI-164,384 | – | 63.5 (3.70–97.7) | 166 | 0.2 | 0.08 | Антиэстроген |
| Фулвестрант | ICI-182,780 | 43.5 (9.4–325) | 21.65 (2.05–40.5) | 0.42 | 1.3 | Антиэстроген |
| Пропилпиразолетриол | PPT | 49 (10.0–89.1) | 0.12 | 0.40 | 92.8 | Агонист ERα |
| 16α-LE2 | 16α-лактон-17β-эстрадиол | 14.6–57 | 0.089 | 0.27 | 131 | Агонист ERα |
| 16α-Йодо-E2 | 16α-йод-17β-эстрадиол | 30.2 | 2.30 | ? | ? | Агонист ERα |
| Метилпиперидинопиразол | MPP | 11 | 0.05 | ? | ? | Антагонист ERα |
| Диарилпропионитрил | ДПН | 0.12–0.25 | 6.6–18 | 32.4 | 1.7 | Агонист ERβ |
| 8β-VE2 | 8β-винил-17β-эстрадиол | 0.35 | 22.0–83 | 12.9 | 0.50 | Агонист ERβ |
| Prinaberel | ЕРБ-041; ПУТЬ-202,041 | 0.27 | 67–72 | ? | ? | Агонист ERβ |
| ЕРБ-196 | ПУТЬ-202 196 | ? | 180 | ? | ? | Агонист ERβ |
| Эртеберел | СЕРБА-1; LY-500,307 | ? | ? | 2.68 | 0.19 | Агонист ERβ |
| СЕРБА-2 | – | ? | ? | 14.5 | 1.54 | Агонист ERβ |
| Куместрол | – | 9.225 (0.0117–94) | 64.125 (0.41–185) | 0.14–80.0 | 0.07–27.0 | Ксеноэстроген |
| Геништейн | – | 0.445 (0.0012–16) | 33.42 (0.86–87) | 2.6–126 | 0.3–12.8 | Ксеноэстроген |
| Equol | – | 0.2–0.287 | 0.85 (0.10–2.85) | ? | ? | Ксеноэстроген |
| Daidzein | – | 0.07 (0.0018–9.3) | 0.7865 (0.04–17.1) | 2.0 | 85.3 | Ксеноэстроген |
| Биоханин А | – | 0.04 (0.022–0.15) | 0.6225 (0.010–1.2) | 174 | 8.9 | Ксеноэстроген |
| Кемпферол | – | 0.07 (0.029–0.10) | 2.2 (0.002–3.00) | ? | ? | Ксеноэстроген |
| Нарингенин | – | 0.0054 (<0.001–0.01) | 0.15 (0.11–0.33) | ? | ? | Ксеноэстроген |
| 8-пренилнарингенин | 8-PN | 4.4 | ? | ? | ? | Ксеноэстроген |
| Кверцетин | – | <0.001–0.01 | 0.002–0.040 | ? | ? | Ксеноэстроген |
| Иприфлавон | – | <0.01 | <0.01 | ? | ? | Ксеноэстроген |
| Мироэстрол | – | 0.39 | ? | ? | ? | Ксеноэстроген |
| Дезоксимироэстрол | – | 2.0 | ? | ? | ? | Ксеноэстроген |
| β-ситостерин | – | <0.001–0.0875 | <0.001–0.016 | ? | ? | Ксеноэстроген |
| Ресвератрол | – | <0.001–0.0032 | ? | ? | ? | Ксеноэстроген |
| α-Зеараленол | – | 48 (13–52.5) | ? | ? | ? | Ксеноэстроген |
| β-Зеараленол | – | 0.6 (0.032–13) | ? | ? | ? | Ксеноэстроген |
| Зеранол | α-Зеараланол | 48–111 | ? | ? | ? | Ксеноэстроген |
| Талеранол | β-Зеараланол | 16 (13–17.8) | 14 | 0.8 | 0.9 | Ксеноэстроген |
| Зеараленон | ZEN | 7.68 (2.04–28) | 9.45 (2.43–31.5) | ? | ? | Ксеноэстроген |
| Зеараланон | ZAN | 0.51 | ? | ? | ? | Ксеноэстроген |
| Бисфенол А | BPA | 0.0315 (0.008–1.0) | 0.135 (0.002–4.23) | 195 | 35 | Ксеноэстроген |
| Эндосульфан | EDS | <0.001–<0.01 | <0.01 | ? | ? | Ксеноэстроген |
| Кепоне | Хлордекон | 0.0069–0.2 | ? | ? | ? | Ксеноэстроген |
| о, п '-DDT | – | 0.0073–0.4 | ? | ? | ? | Ксеноэстроген |
| п, п '-DDT | – | 0.03 | ? | ? | ? | Ксеноэстроген |
| Метоксихлор | п, п '-Диметокси-ДДТ | 0.01 (<0.001–0.02) | 0.01–0.13 | ? | ? | Ксеноэстроген |
| HPTE | Гидроксихлор; п, п '-ОН-ДДТ | 1.2–1.7 | ? | ? | ? | Ксеноэстроген |
| Тестостерон | Т; 4-Андростенолон | <0.0001–<0.01 | <0.002–0.040 | >5000 | >5000 | Андроген |
| Дигидротестостерон | DHT; 5α-Андростанолон | 0.01 (<0.001–0.05) | 0.0059–0.17 | 221–>5000 | 73–1688 | Андроген |
| Нандролон | 19-нортестостерон; 19-NT | 0.01 | 0.23 | 765 | 53 | Андроген |
| Дегидроэпиандростерон | DHEA; Прастерон | 0.038 (<0.001–0.04) | 0.019–0.07 | 245–1053 | 163–515 | Андроген |
| 5-Андростендиол | A5; Андростендиол | 6 | 17 | 3.6 | 0.9 | Андроген |
| 4-Андростендиол | – | 0.5 | 0.6 | 23 | 19 | Андроген |
| 4-Андростендион | A4; Андростендион | <0.01 | <0.01 | >10000 | >10000 | Андроген |
| 3α-Андростандиол | 3α-Адиол | 0.07 | 0.3 | 260 | 48 | Андроген |
| 3β-Андростандиол | 3β-Адиол | 3 | 7 | 6 | 2 | Андроген |
| Андростандион | 5α-Андростандион | <0.01 | <0.01 | >10000 | >10000 | Андроген |
| Этиохоландион | 5β-Андростандион | <0.01 | <0.01 | >10000 | >10000 | Андроген |
| Метилтестостерон | 17α-метилтестостерон | <0.0001 | ? | ? | ? | Андроген |
| Этинил-3α-андростандиол | 17α-этинил-3α-адиол | 4.0 | <0.07 | ? | ? | Эстроген |
| Этинил-3β-андростандиол | 17α-этинил-3β-адиол | 50 | 5.6 | ? | ? | Эстроген |
| Прогестерон | P4; 4-прегненедион | <0.001–0.6 | <0.001–0.010 | ? | ? | Прогестаген |
| Норэтистерон | СЕТЬ; 17α-этинил-19-NT | 0.085 (0.0015–<0.1) | 0.1 (0.01–0.3) | 152 | 1084 | Прогестаген |
| Норэтинодрел | 5 (10) -норэтистерон | 0.5 (0.3–0.7) | <0.1–0.22 | 14 | 53 | Прогестаген |
| Тиболон | 7α-метилноретинодрел | 0.5 (0.45–2.0) | 0.2–0.076 | ? | ? | Прогестаген |
| Δ4-Тиболон | 7α-метилноэтистерон | 0.069–<0.1 | 0.027–<0.1 | ? | ? | Прогестаген |
| 3α-гидрокситиболон | – | 2.5 (1.06–5.0) | 0.6–0.8 | ? | ? | Прогестаген |
| 3β-гидрокситиболон | – | 1.6 (0.75–1.9) | 0.070–0.1 | ? | ? | Прогестаген |
| Сноски: а = (1) Связывание сродства значения имеют формат «медиана (диапазон)» (# (# - #)), «диапазон» (# - #) или «значение» (#) в зависимости от доступных значений. Полные наборы значений в пределах диапазонов можно найти в коде Wiki. (2) Аффинность связывания определяли с помощью исследований замещения в различных in vitro системы с маркированный эстрадиол и человек ERα и ERβ белки (кроме значений ERβ из Kuiper et al. (1997), которые представляют собой ERβ крысы). Источники: См. Страницу шаблона. | ||||||
| Эстроген | Относительное сродство связывания (%) | ||||||
|---|---|---|---|---|---|---|---|
| ER | AR | PR | GR | МИСТЕР | SHBG | CBG | |
| Эстрадиол | 100 | 7.9 | 2.6 | 0.6 | 0.13 | 8.7–12 | <0.1 |
| Бензоат эстрадиола | ? | ? | ? | ? | ? | <0.1–0.16 | <0.1 |
| Эстрадиола валерат | 2 | ? | ? | ? | ? | ? | ? |
| Estrone | 11–35 | <1 | <1 | <1 | <1 | 2.7 | <0.1 |
| Эстрона сульфат | 2 | 2 | ? | ? | ? | ? | ? |
| Эстриол | 10–15 | <1 | <1 | <1 | <1 | <0.1 | <0.1 |
| Equilin | 40 | ? | ? | ? | ? | ? | 0 |
| Альфатрадиол | 15 | <1 | <1 | <1 | <1 | ? | ? |
| Эпиестриол | 20 | <1 | <1 | <1 | <1 | ? | ? |
| Этинилэстрадиол | 100–112 | 1–3 | 15–25 | 1–3 | <1 | 0.18 | <0.1 |
| Местранол | 1 | ? | ? | ? | ? | <0.1 | <0.1 |
| Метилэстрадиол | 67 | 1–3 | 3–25 | 1–3 | <1 | ? | ? |
| Моксестрол | 12 | <0.1 | 0.8 | 3.2 | <0.1 | <0.2 | <0.1 |
| Диэтилстильбестрол | ? | ? | ? | ? | ? | <0.1 | <0.1 |
| Примечания: Ссылка лиганды (100%) были прогестерон для PR, тестостерон для AR, эстрадиол для ER, дексаметазон для GR, альдостерон для МИСТЕР, дигидротестостерон за SHBG, и кортизол за CBG. Источники: См. Шаблон. | |||||||
| Эстроген | HF | VE | UCa | ФСГ | LH | HDL-C | SHBG | CBG | AGT | Печень |
|---|---|---|---|---|---|---|---|---|---|---|
| Эстрадиол | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 |
| Estrone | ? | ? | ? | 0.3 | 0.3 | ? | ? | ? | ? | ? |
| Эстриол | 0.3 | 0.3 | 0.1 | 0.3 | 0.3 | 0.2 | ? | ? | ? | 0.67 |
| Эстрона сульфат | ? | 0.9 | 0.9 | 0.8–0.9 | 0.9 | 0.5 | 0.9 | 0.5–0.7 | 1.4–1.5 | 0.56–1.7 |
| Конъюгированные эстрогены | 1.2 | 1.5 | 2.0 | 1.1–1.3 | 1.0 | 1.5 | 3.0–3.2 | 1.3–1.5 | 5.0 | 1.3–4.5 |
| Эквилин сульфат | ? | ? | 1.0 | ? | ? | 6.0 | 7.5 | 6.0 | 7.5 | ? |
| Этинилэстрадиол | 120 | 150 | 400 | 60–150 | 100 | 400 | 500–600 | 500–600 | 350 | 2.9–5.0 |
| Диэтилстильбестрол | ? | ? | ? | 2.9–3.4 | ? | ? | 26–28 | 25–37 | 20 | 5.7–7.5 |
Источники и сноски Примечания: Значения являются соотношениями, стандартным является эстрадиол (т. Е. 1,0). Сокращения: HF = Клиническое облегчение приливы. VE = Увеличено распространение из вагинальный эпителий. UCa = Уменьшение UCa. ФСГ = Подавление ФСГ уровни. LH = Подавление LH уровни. HDL-C, SHBG, CBG, и AGT = Повышение уровня этих белки печени. Печень = отношение эстрогенных эффектов печени к общим / системным эстрогенным эффектам (приливы /гонадотропины). Источники: См. Шаблон. | ||||||||||
| Сложный | Дозировка для конкретного использования (обычно мг)[а] | ||||||
|---|---|---|---|---|---|---|---|
| ETD[b] | EPD[b] | MSD[b] | MSD[c] | OID[c] | TSD[c] | ||
| Эстрадиол (немикронный) | 30 | ≥120–300 | 120 | 6 | - | - | |
| Эстрадиол (микронизированный) | 6–12 | 60–80 | 14–42 | 1–2 | >5 | >8 | |
| Эстрадиола валерат | 6–12 | 60–80 | 14–42 | 1–2 | - | >8 | |
| Бензоат эстрадиола | - | 60–140 | - | - | - | - | |
| Эстриол | ≥20 | 120–150[d] | 28–126 | 1–6 | >5 | - | |
| Эстриола сукцинат | - | 140–150[d] | 28–126 | 2–6 | - | - | |
| Эстрона сульфат | 12 | 60 | 42 | 2 | - | - | |
| Конъюгированные эстрогены | 5–12 | 60–80 | 8.4–25 | 0.625–1.25 | >3.75 | 7.5 | |
| Этинилэстрадиол | 200 мкг | 1–2 | 280 мкг | 20–40 мкг | 100 мкг | 100 мкг | |
| Местранол | 300 мкг | 1.5–3.0 | 300–600 мкг | 25–30 мкг | > 80 мкг | - | |
| Quinestrol | 300 мкг | 2–4 | 500 мкг | 25–50 мкг | - | - | |
| Метилэстрадиол | - | 2 | - | - | - | - | |
| Диэтилстильбестрол | 2.5 | 20–30 | 11 | 0.5–2.0 | >5 | 3 | |
| DES дипропионат | - | 15–30 | - | - | - | - | |
| Диенестрол | 5 | 30–40 | 42 | 0.5–4.0 | - | - | |
| Диенэстрола диацетат | 3–5 | 30–60 | - | - | - | - | |
| Гексэстрол | - | 70–110 | - | - | - | - | |
| Хлортрианизен | - | >100 | - | - | >48 | - | |
| Металленестрил | - | 400 | - | - | - | - | |
Источники и сноски: | |||||||
Антиандрогенный и антигонадотропный эффекты
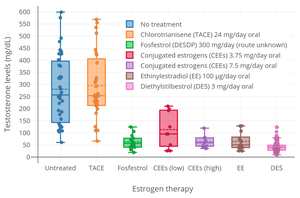
EE - мощный функционал антиандроген как у женщин, так и у мужчин.[104] Он опосредует свои антиандрогенные эффекты за счет 1) стимуляции производство из глобулин, связывающий половые гормоны (SHBG) в печень, что снижает концентрацию свободного и, следовательно, биологически активного тестостерона в крови; и 2) подавлением лютеинизирующий гормон (LH) секреция от гипофиз, что снижает выработку тестостерона гонады.[104][105][22][106] Противозачаточные таблетки, содержащие ЭЭ, полезны при лечении андроген-зависимые состояния подобно угревая сыпь и гирсутизм в силу их антиандрогенного действия.[104][107]
Было обнаружено, что противозачаточные таблетки, содержащие ЭЭ, повышают уровень циркулирующего ГСПГ в 2–4 раза у женщин и снижают концентрацию свободного тестостерона на 40–80%.[22] Противозачаточные таблетки, содержащие высокие дозы ЭЭ, могут повышать уровень ГСПГ у женщин в 5-10 раз.[51] Это похоже на 5-10-кратное увеличение уровня SHBG, которое происходит во время беременность.[51] Из-за заметного увеличения уровня SHBG уровень свободного тестостерона становится очень низким во время лечения противозачаточными таблетками, содержащими EE.[10] У мужчин исследование показало, что лечение относительно низкой дозировкой 20 мкг / день ЭЭ в течение пяти недель увеличивало уровни циркулирующего SHBG на 150% и, из-за сопутствующего снижения уровней свободного тестостерона, увеличивало общие уровни циркулирующего тестостерона на 50%. (через усиление выработки тестостерона гонадой из-за снижения негативный отзыв андрогенами на гипоталамо-гипофизарно-гонадная ось).[105] Стимуляция выработки ГСПГ печенью ЭЭ намного сильнее, чем с помощью других эстрогенов, таких как эстрадиол, из-за высокой устойчивости ЭЭ к инактивации в печени и, следовательно, его непропорционального воздействия на эту часть тела.[7][10][108]
Эстрогены антигонадотропины и способны подавлять секрецию ЛГ и ФСГ гипофизом и за счет увеличения выработки гонадного тестостерона.[109][110] Эстроген в высоких дозах терапия, в том числе с ЭЭ, может снизить уровень тестостерона у мужчин примерно на 95% или до диапазона кастрат / женский.[111][109][110] Дозировка EE, необходимая для использования в качестве компонента гормональная терапия для предоперационной трансгендерные женщины составляет от 50 до 100 мкг / день.[112] Эта высокая дозировка связана с высокой частотой ВТЭ, особенно у лиц старше 40 лет, и было сказано, что ее не следует использовать.[112] Дозировка ЭЭ, используемая для лечения рака простаты у мужчин, составляет от 150 до 1000 мкг / день (0,15–1,0 мг / день).[8][113] Было обнаружено, что доза ЭЭ 50 мкг два раза в день (всего 100 мкг / день) снижает уровень тестостерона у мужчин в такой же степени, как 3 мг / день перорально. диэтилстильбестрол, которая представляет собой минимальную дозу диэтилстильбестрола, необходимую для постоянного подавления уровня тестостерона до уровня кастрации.[114] Доза EE, подавляющая овуляцию, сама по себе, а не в комбинации с прогестином, у женщин составляет 100 мкг / день.[115][116] Однако было обнаружено, что он примерно на 75-90% эффективен при ингибировании овуляции при дозировке 20 мкг / день и примерно на 97 или 98% эффективен при дозировке 50 мкг / день.[117][118][119][120] В другом исследовании овуляция произошла у 25,2% при дозе ЭЭ 50 мкг / день.[121]
Более низкие дозировки EE также обладают значительным антигонадотропным действием.[112] «Очень низкая» доза 15 мкг / день ЭЭ была описана как «пограничное» количество, необходимое для подавления уровней ЛГ и тестостерона у мужчин, и исследование показало, что уровни ЛГ и тестостерона «надежно» подавлялись у мужчин за счет дозировка 30 мкг / сут EE.[8] Однако другие клинические исследования показали, что 20 мкг / день ЭЭ повышают уровень тестостерона на 50% у мужчин (как описано выше).[105] и что дозы 32 мкг / день и 42 мкг / день ЭЭ подавляли уровни ФСГ у мужчин, но не оказывали значительного влияния на уровни ЛГ.[8] Более сильное подавление уровня тестостерона наблюдалось у мужчин после ежедневного лечения комбинированным пероральным контрацептивом, содержащим 50 мкг этинилэстрадиола и 0,5 мг. норгестрел на 9 дней.[8] Однако исследование показало, что прогестин был более важным компонентом, ответственным за подавление уровня тестостерона.[8] Соответственно, прогестиновый компонент КОК в первую очередь отвечает за ингибирование овуляция у женщин.[8] Комбинация 20 мкг / день ЭЭ и 10 мг / день метилтестостерон было обнаружено, что подавляет секрецию ФСГ у мужчин в степени, достаточной для прекращения сперматогенез.[8] Исследования на женщинах показали, что 50 мкг / день ЭЭ подавляют уровни ЛГ и ФСГ примерно на 70% у женщин в постменопаузе.[83]
Помимо своего антигонадотропного действия, ЭЭ может значительно подавлять выработку андрогенов надпочечники в высоких концентрациях.[8][122][123] Одно исследование показало, что лечение высокой дозой 100 мкг / день ЭЭ подавляло циркуляцию крови. надпочечниковый андроген уровни от 27 до 48% у трансгендерных женщин.[8][122][123] Это может дополнительно способствовать подавлению уровня андрогенов эстрогенами.[8][122][123]
Влияние на синтез белка в печени
ЭЭ оказывает заметное влияние на синтез белка в печени, даже при низких дозировках и независимо от путь введения.[8][7] Эти эффекты опосредованы его эстрогенной активностью.[8][7] Лекарство дозозависимо увеличивает циркулирующие уровни ГСПГ, кортикостероид-связывающий глобулин (CBG) и тироксин-связывающий глобулин (TBG), а также влияет на широкий спектр других белков печени.[8][7] ЭЭ влияет триглицерид уровни при дозе всего 1 мкг / день и ЛПНП и Холестерин HDL уровни при дозе всего 2,5 мкг / день.[124] ЭЭ влияет на несколько белков печени при дозировке всего 5 мкг / день.[8] При дозах выше 20 мкг / день дополнительные эффекты ЭЭ на синтез белка в печени становятся все меньше.[8]
Было обнаружено, что ЭЭ в дозе 5 мкг / день увеличивает уровни SHBG на 100% у женщин в постменопаузе, в то время как дозировка 20 мкг / день увеличивает их на 200%.[8] Андрогены снижают продукцию ГСПГ в печени и, как было обнаружено, противодействуют влиянию ЭЭ на уровни ГСПГ.[8] Это особенно актуально, если учесть, что многие прогестины, используемые в КОК, обладают различной степенью слабой андрогенной активности.[8] Комбинация 20 мкг / день ЭЭ и 0,25 мг / день левоноргестрелпрогестин с относительно высокой андрогенностью снижает уровень SHBG на 50%; 30 мкг / день EE и 0,25 мг / день левоноргестрела не влияют на уровни SHBG; 30 мкг / день EE и 0,15 мг / день левоноргестрела повышают уровень SHBG на 30%; и трехфазный КОК, содержащие ЭЭ и левоноргестрел, повышают уровень ГСПГ на 100–150%.[8] Комбинация 30 мкг / день ЭЭ и 150 мкг / день дезогестрелпрогестин с относительно слабой андрогенной активностью, чем левоноргестрел, увеличивает уровень ГСПГ на 200%, в то время как комбинация 35 мкг / день ЭЭ и 2 мг / день ципротерона ацетат, прогестин с мощным антиандрогенный активность, увеличивает уровень SHBG на 400%.[8] Таким образом, тип и дозировка прогестина, содержащегося в КОК, значительно снижает влияние ЭЭ на уровни SHBG.[8]
Было обнаружено, что доза 10 мкг / день EE увеличивает уровни CBG на 50%, а доза 20 мкг / день EE увеличивает их на 100%.[8] Прогестины, являющиеся производными прогестерона, не влияют на уровень CBG, в то время как андрогенные прогестины, такие как 19-нортестостерон производные слабо влияют на уровень CBG.[8] КОК могут повышать уровень КБГ на 100–150%.[8] Было обнаружено, что доза 5 мкг / день ЭЭ увеличивает уровни ТБГ на 40%, тогда как доза 20 мкг / день ЭЭ увеличивает их на 60%.[8] Прогестины, являющиеся производными прогестерона, не влияют на уровень ТБГ, в то время как прогестины с андрогенной активностью могут снижать уровни ТБГ.[8] Комбинация 30 мкг / день ЭЭ и 1 мг / день норэтистеронумеренно андрогенный прогестин, как было обнаружено, увеличивает уровни ТБГ на 50-70%, в то время как комбинация 30 мкг / день ЭЭ и 150 мкг / день дезогестрела повышала их на 100%.[8]
Отличия от эстрадиола


ЭЭ оказывает сильное и непропорциональное воздействие на синтез белка в печени относительно эстрадиола.[7] В печень так же хорошо как матка выражать 17β-гидроксистероид дегидрогеназа (17β-HSD), и это фермент служит для инактивации эстрадиола и эффективного подавления его активности в этих тканях, обратимо превращая его в гораздо менее мощный эстроген. эстрон (который имеет примерно 4% эстрогенной активности эстрадиола).[7] В отличие от эстрадиола, 17α-этинильная группа EE предотвращает окисление положения C17β EE с помощью 17β-HSD, и по этой причине EE не инактивируется в этих тканях и имеет гораздо более сильную относительную эстрогенную активность в них.[7][125][11] Это механизм непропорционально сильного воздействия ЭЭ на продукцию белка в печени.[7][125] что приводит к значительно большему влиянию эстрадиола на ВТЭ и сердечно-сосудистые риски.[126]
С другой стороны, из-за потери инактивации EE 17β-HSD в эндометрий (матка), ЭЭ относительно более активен в эндометрии, чем эстрадиол, и по этой причине связан со значительно более низкой частотой вагинальное кровотечение и кровянистые выделения в сравнении.[7] Это особенно верно в случае комбинированной терапии эстрогенами и прогестагенами (например, при приеме КОК или менопаузальной ЗГТ), поскольку прогестагены индуцируют экспрессию 17β-HSD в эндометрии.[7] Уменьшение вагинального кровотечения и кровянистых выделений при ЭЭ является одной из основных причин того, что он используется в КОК вместо эстрадиола.[3] несмотря на потенциально худший профиль безопасности (связанный с его побочными эффектами на синтез печеночного белка и частоту ВТЭ).[127]
Было обнаружено, что ЭЭ оказывает непропорциональное влияние на синтез белка в печени и риск ВТЭ независимо от того, путь введения является пероральным, трансдермальным или вагинальным, что указывает на использование парентеральный пути перорального пути не приводят к тому, что ЭЭ оказывает пропорциональное воздействие на печень по сравнению с действием на печень.[125][8] Однако эффективность ЭЭ в отношении синтеза белка в печени в любом случае снижается при парентеральном введении.[8] Было обнаружено, что доза 10 мкг / день вагинального ЭЭ эквивалентна 50 мкг перорального ЭЭ с точки зрения воздействия на синтез белка в печени, такого как стимуляция выработки печеночного SHBG.[8] Таким образом, парентеральное ЭЭ, которое обходит первое прохождение через печень, которое происходит при пероральном ЭЭ, оказывает в 5 раз меньшее влияние на синтез белка в печени по массе, чем пероральное ЭЭ.[8] В отличие от ЭЭ, а также перорального эстрадиола, трансдермальный эстрадиол практически не влияет на синтез белка в печени при типичных дозах для менопаузы.[7]
| Параметры | Эстрадиол | Этинилэстрадиол |
|---|---|---|
| ER близость | 1 × 1010 M-1 | 2–5 × 1011 M-1 |
| Ядерное удержание | 6–8 часов | 24 часа |
| Период полувыведения | 90 минут | 7 часов |
| Субстрат за 17β-HSD? | да | Нет |
| Граница к SHBG? | да | Нет |
| Относительный устный печень потенция | 1 | ~500–1,500 |
| Относительный устный гипофиз потенция | 1 | 200 |
| Источники:[55] | ||
Фармакокинетика
Абсорбция
В устный биодоступность ЭЭ составляет в среднем 45% с широким диапазоном от 20% до 74% (хотя чаще всего от 38 до 48%), что связано с высоким межиндивидуальная изменчивость.[10][4] Несмотря на то, что пероральная биодоступность EE относительно низкая, она значительно выше, чем у микронизированного эстрадиола (5%).[2][10] После однократного приема 20 мкг ЭЭ в сочетании с 2 мг норэтистерона ацетат У женщин в постменопаузе концентрация ЭЭ достигает максимума 50 пг / мл в среднем за 1,5 часа.[7] После первой дозы средний уровень ЭЭ в целом увеличивается примерно на 50% до тех пор, пока установившиеся концентрации достигнуты;[7][128] устойчивое состояние достигается после одной недели ежедневного приема.[8] Для сравнения, средние пиковые уровни эстрадиола, достигнутые с 2 мг микронизированного эстрадиола или эстрадиола валерат составляют 40 пг / мл после первой дозы и 80 пг / мл после трех недель приема.[7] Эти максимальные концентрации эстрадиола находятся в том же диапазоне, что и концентрации EE, которые продуцируются пероральной дозой EE, которая в 100 раз ниже по весу, что соответствует примерно 100-кратному увеличению пероральной активности EE по сравнению с эстрадиолом. .[79][7] В соответствии с высокой индивидуальной вариабельностью биодоступности ЭЭ при пероральном приеме, существует большая степень индивидуальной вариабельности уровней ЭЭ.[7][129] Было обнаружено, что дозировка EE 50 мкг / день позволяет достичь широкого диапазона уровней циркулирующего EE от примерно 100 до 2000 пг / мл.[130][129] Использование ЭЭ в сочетании с высокимтолстый Было обнаружено, что еда значительно снижает его пиковые концентрации.[128][7]
Уровни ЭЭ после однократной дозы 50 мкг при внутривенной инъекции в несколько раз превышают уровни ЭЭ после однократной дозы 50 мг, введенной перорально.[130] Помимо разницы в уровнях, ход исключения для двух маршрутов схож.[130]
Могут быть гендерные различия в фармакокинетика ЭЭ, так что ЭЭ может иметь большую пероральную потенцию у женщин, чем у мужчин.[8] Исследование показало, что комбинация 60 мкг / день ЭЭ и 0,25 мг / день левоноргестрел у женщин и мужчин пиковые уровни ЭЭ составили 495 пг / мл и 251 пг / мл, уровни площади под кривой EE 6,216 пг / мл / час и 2,850 пг / мл / час, и период полувыведения 16,5 часа и 10,2 часа соответственно.[8] Было высказано предположение, что это явление могло представлять «механизм защиты» мужчин от экологический эстроген контакт.[8]
Распределение
В связывание с белками плазмы ЭЭ составляет от 97 до 98%, и он связан почти исключительно с альбумин.[5][7][10][131] В отличие от эстрадиола, который связывается с высоким сродством с SHBG, EE имеет очень низкое сродство к этому белку, около 2% от аффинности эстрадиола, и, следовательно, не связывается с ним в значительной степени.[132]
Метаболизм
Из-за высокого метаболизма первого прохождения в кишечник и печеньтолько 1% пероральной дозы ЭЭ попадает в кровоток как сам ЭЭ.[7] Во время метаболизма первого прохождения ЭЭ широко сопряженный через глюкуронизация и сульфатирование в гормонально инертный этинилэстрадиол глюкурониды и сульфат этинилэстрадиола (Сульфат EE), а уровни сульфата EE в циркуляции в 6–22 раза выше, чем уровни EE.[7][4] Для сравнения, при пероральном приеме 2 мг микронизированного эстрадиола уровни эстрон и эстрон сульфат в 4-6 раз и в 200 раз выше, чем у эстрадиола, соответственно.[7] В отличие от эстрадиола, ЭЭ из-за стерическое препятствие своей этинильной группой C17α, не метаболизируется и не инактивируется 17β-HSD,[11] и это основной фактор, ответственный за резкое повышение эффективности перорального ЭЭ по сравнению с пероральным эстрадиолом.[7]
Помимо сульфатной конъюгации, ЭЭ в основном метаболизируется к гидроксилирование в катехол эстрогены.[7] В основном это происходит за счет 2-гидроксилирования в 2-гидрокси-EE, которое катализируется главным образом CYP3A4.[10] Также сообщалось о гидроксилировании EE в положениях C4, C6α и C16β в 4-, 6α- и 16β-гидрокси-EE, но, по-видимому, вносит вклад в его метаболизм лишь в небольшой степени.[10] 2- и 4-метокси-EE также образуются путем превращения катехол-O-метилтрансфераза 2- и 4-гидрокси-EE.[7] В отличие от эстрадиола, 16α-гидроксилирование не происходит с EE из-за стерическое препятствие своей этинильной группой при C17α.[10][7] Этинилирование EE в значительной степени необратимо, поэтому EE не метаболизируется в эстрадиол, в отличие от эфиры эстрадиола.[7] Обзор показал, что диапазон заявленных период полувыведения EE в литературе составляет от 13,1 до 27,0 часов.[2] В другом обзоре сообщалось, что период полувыведения EE составляет от 10 до 20 часов.[10] Однако, по сообщениям других источников, период полувыведения ЭЭ составляет всего 7 часов.[11] и целых 36 часов.[9]
В отличие от эстрадиола, в котором наблюдается быстрый рост его уровней и который остается повышенным по платообразной кривой в течение многих часов, уровни ЭЭ быстро падают после достижения пика.[7] Считается, что это связано с тем, что эстрон и сульфат эстрона могут обратимо превращаться обратно в эстрадиол и служить гормонально инертным резервуаром для эстрадиола, тогда как резервуар сульфата EE для EE намного меньше по сравнению с этим.[7][4] В любом случае из-за образования сульфата ЭЭ энтерогепатическая рециркуляция участвует в фармакокинетика ЭЭ аналогичен эстрадиолу, хотя и в меньшей степени.[7][133] Вклад энтерогепатической рециркуляции в общий уровень циркулирующего ЭЭ составляет от 12 до 20% или меньше и не наблюдается постоянно.[8][133] Вторичный пик уровней ЭЭ через 10–14 часов после приема часто наблюдается при пероральном приеме ЭЭ.[133]
EE, после окислительный образование очень реактивного метаболит, необратимо подавляет цитохром P450 ферменты участвует в его метаболизме, и это также может играть роль в повышении эффективности ЭЭ по сравнению с эстрадиолом.[7] Действительно, считается, что ЭЭ оказывает заметное влияние на метаболизм в печени, и это одна из причин, среди прочего, что природные эстрогены, такие как эстрадиол, могут быть предпочтительнее.[131] После 1 года терапии наблюдалось 2-кратное накопление уровней ЭЭ при применении КОК, содержащих ЭЭ.[133]
Устранение
EE - это устранен 62% в кал и 38% в моча.[10]
Химия
EE, также известный как 17α-этинилэстрадиол или 17α-этинилэстра-1,3,5 (10) -триен-3,17β-диол, представляет собой синтетический эстран стероидный препарат и производная из эстрадиол с этинильное замещение в позиции C17α.[1][134] 17α-этинилирование эстрадиола с образованием EE аналогично 17α-замещению тестостерон для производства производных тестостерона, таких как 17α-этинилированные прогестины, такие как этистерон (17α-этинилтестостерон) и норэтистерон (17α-этинил-19-нортестостерон), а также 17α-алкилированный андрогены/анаболические стероиды подобно метилтестостерон (17α-метилтестостерон).
Аналоги
Номер производные ЭЭ существуют.[1][134] К ним относятся местранол (ЭЭ 3-метиловый эфир), квинестрол (ЭЭ 3-циклопентиловый эфир), сульфонат этинилэстрадиола (EE 3-изопропилсульфонат) и моксестрол (11β-метокси-EE).[1][134][8] Первые три пролекарства EE, а последний - нет.[8] Немного аналоги ЭЭ с другими замены в позиции C17α существуют.[1][134] Примеры включают производные эстрадиола. метилэстрадиол (17α-метилэстрадиол) и этилэстрадиол (17α-этилэстрадиол) и эстриол производные этинилэстриол (17α-этинилэстриол) и нилестриол (17α-этинилэстриол-3-циклопентиловый эфир).[1][134] Андростан аналоги EE со значительной, хотя и слабой эстрогенной активностью включают: этиниландростендиол (17α-этинил-5-андростендиол), 17α-этинил-3β-андростандиол, 17α-этинил-3α-андростандиол, и метандриол (17α-метил-5-андростендиол).
История
ЭЭ был первым синтетическим эстрогеном, активным перорально, и был описан в 1938 году Гансом Херлоффом Инхоффеном и Вальтером Хольвегом из Schering AG в Берлин.[135][136][137][138][139] Он был одобрен FDA в НАС. 25 июня 1943 г. и продавалась Шеринг под торговой маркой Эстинил.[14] FDA отозвало одобрение препарата Эстинил с 4 июня 2004 г. по запросу Шеринг, который прекратил продавать его.[140]
EE никогда не использовался внутримышечная инъекция.[141]
ЭЭ впервые был использован в КОК в качестве альтернативы местранол, в 1964 году, а вскоре после этого заменил местранол в составе КОК.[15]
Ранние КОК содержали от 40 до 100 мкг / день ЭЭ и от 50 до 150 мкг / день местранола.[142][143]
Общество и культура
Родовые имена
Этинилэстрадиол это английский родовое имя препарата и его ГОСТИНИЦА, USAN, БАН, и ЯНВАРЬ.[144][1][145][134] Это также было написано как этинилэстрадиол, этинилоэстрадиол, и этинилэстрадиол (все имеют одинаковое произношение), и последний БАН но со временем был изменен.[144][1][134] Кроме того, в имя EE часто включается пробел, который записывается как этинилэстрадиол (а также его вариации), и это его USP имя.[144][134] Общее название EE в Французский и это DCF находятся этинилэстрадиол, в испанский является этинилэстрадиол, в Итальянский и это DCIT находятся этинилэстрадиоло, И в латинский является этинилэстрадиол.[144][134]
Название препарата часто сокращается как EE или как EE2 в медицинская литература.
Фирменные наименования
EE был продан как самостоятельный пероральный препарат под торговыми марками. Эстид, Эстинил, Feminone, Lynoral, Менолин, Новестрол, Палонил, Спанестрин, и Илестрол среди прочего, хотя большинство или все эти составы в настоящее время прекращены.[146][147][134] Он продается под очень большим количеством торговых марок по всему миру в сочетании с прогестинами для использования в качестве орального контрацептива.[144] Кроме того, EE продается в НАС. в комбинации с норэлгестромин под торговыми марками Орто Эвра и Xulane как противозачаточный пластырь, в комбинации с этоногестрел под торговой маркой НоваРинг как контрацептивное вагинальное кольцо, и в сочетании с норэтистерона ацетат под торговой маркой FemHRT в пероральной заместительной гормональной терапии для лечения симптомов менопаузы.[12]
Доступность
EE широко продается по всему миру.[144][134] Он продается исключительно или почти исключительно в сочетании с прогестинами.[144]
Рекомендации
- ^ а б c d е ж грамм час Дж. Элкс (14 ноября 2014 г.). Словарь лекарственных средств: химические данные: химические данные, структуры и библиографии. Springer. С. 522–. ISBN 978-1-4757-2085-3.
- ^ а б c d Goldzieher JW, Brody SA (1990). «Фармакокинетика этинилэстрадиола и местранола». Американский журнал акушерства и гинекологии. 163 (6, п. 2): 2114–9. Дои:10.1016 / 0002-9378 (90) 90550-Q. PMID 2256522.
- ^ а б Фруцетти Ф, Тремольер Ф, Битцер Дж (2012). «Обзор разработки комбинированных пероральных контрацептивов, содержащих эстрадиол: акцент на эстрадиола валерате / диеногесте». Гинекологическая эндокринология. 28 (5): 400–8. Дои:10.3109/09513590.2012.662547. ЧВК 3399636. PMID 22468839.
- ^ а б c d Фотерби К. (август 1996 г.). «Биодоступность пероральных половых стероидов, используемых в оральной контрацепции и заместительной гормональной терапии». Контрацепция. 54 (2): 59–69. Дои:10.1016/0010-7824(96)00136-9. PMID 8842581.
- ^ а б Факты и сравнения (Фирма); Ovid Technologies, Inc (2005 г.). Факты о наркотиках и сравнения 2005: Карманная версия. Факты и сравнения. п. 121. ISBN 978-1-57439-179-4.
- ^ Micromedex (1 января 2003 г.). USP DI 2003: Информация о лекарствах для медицинских работников. Томсон Микромедекс. С. 1253, 1258, 1266. ISBN 978-1-56363-429-1.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах ай эй ак аль являюсь ан ао ap водный ар в качестве Kuhl H (2005). «Фармакология эстрогенов и прогестагенов: влияние разных путей введения» (PDF). Климактерический. 8 Дополнение 1: 3–63. Дои:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах ай эй ак аль являюсь ан ао ap водный ар в качестве в au Майкл Эттель; Эккехард Шиллингер (6 декабря 2012 г.). Эстрогены и антиэстрогены II: фармакология и клиническое применение эстрогенов и антиэстрогенов. Springer Science & Business Media. С. 4, 10, 15, 165, 247–248, 276–291, 363–408, 424, 514, 540, 543, 581. ISBN 978-3-642-60107-1.
Аффинность связывания EE2 с рецептором эстрогена аналогична таковой у эстрадиола. [...] Во время ежедневного приема уровни EE2 повышаются до устойчивого состояния, которое достигается примерно через 1 неделю.
- ^ а б c Клод Л. Хьюз; Майкл Д. Уотерс (23 марта 2016 г.). Трансляционная токсикология: определение новой терапевтической дисциплины. Humana Press. С. 73–. ISBN 978-3-319-27449-2.
- ^ а б c d е ж грамм час я j k л м п Станчик Ф.З., Арчер Д.Ф., Бхавнани Б.Р. (2013). «Этинилэстрадиол и 17β-эстрадиол в комбинированных пероральных контрацептивах: фармакокинетика, фармакодинамика и оценка риска». Контрацепция. 87 (6): 706–27. Дои:10.1016 / j.contraception.2012.12.011. PMID 23375353.
- ^ а б c d Шелленбергер, Т. Э. (1986). «Фармакология эстрогенов». Климактерический период в перспективе. С. 393–410. Дои:10.1007/978-94-009-4145-8_36. ISBN 978-94-010-8339-3.
Этинилэстрадиол - синтетический и сравнительно мощный эстроген. В результате алкилирования в положении 17-C он не является субстратом для 17β дегидрогеназы, фермента, который превращает природный эстрадиол-17β в менее мощный эстрон в органах-мишенях.
Отсутствует или пусто| название =(помощь) - ^ а б c d "Drugs @ FDA: одобренные FDA лекарственные препараты". Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Получено 22 декабря 2016.
- ^ Фишер, Янош; Ганеллин, С. Робин (2006). Открытие лекарств на основе аналогов. Джон Вили и сыновья. п. 482. ISBN 9783527607495.
- ^ а б FDA (2007). "История одобрений: Эстинил (этинилэстрадиол) NDA 005292". поиск: Эстинил
- ^ а б J.G. Грун; Р.Р. Казер (11 ноября 2013 г.). Гормональная регуляция менструального цикла: эволюция представлений. Springer Science & Business Media. С. 185–. ISBN 978-1-4899-3496-3.
В 1964 году этинилэстрадиол был представлен в качестве альтернативы местранолу в качестве эстрогенного компонента, [...]
- ^ Эванс Г, Саттон Э.Л. (2015). «Оральная контрацепция». Med Clin North Am. 99 (3): 479–503. Дои:10.1016 / j.mcna.2015.01.004. PMID 25841596.
- ^ Донна Шоуп; Флоренс П. Хазелтин (6 декабря 2012 г.). Контрацепция. Springer Science & Business Media. С. 112–. ISBN 978-1-4612-2730-4.
- ^ Хамода, Панай, Арья, Саввас, Х, Н, Р (2016). "Рекомендации Британского общества по менопаузе и женского здоровья, 2016 г., по заместительной гормональной терапии у женщин в период менопаузы". Пострепродуктивное здоровье. 22 (4): 165–183. Дои:10.1177/2053369116680501.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Унгер CA (2016). «Гормональная терапия для трансгендерных пациентов». Перевод Андрол Урол. 5 (6): 877–884. Дои:10.21037 / тау.2016.09.04. ЧВК 5182227. PMID 28078219.
- ^ а б Колинг Беннинк Х. Дж., Верховен С., Датман А. Е., Тейссен Дж. (Январь 2017 г.). «Использование высоких доз эстрогенов для лечения рака груди». Maturitas. 95: 11–23. Дои:10.1016 / j.maturitas.2016.10.010. PMID 27889048.
- ^ «Менопаузальная гормональная терапия и риск рака». Американское онкологическое общество. 13 февраля 2015 года.
- ^ а б c Рабочая группа МАИР по оценке канцерогенных рисков для человека; Всемирная организация здоровья; Международное агентство по изучению рака (2007 г.). Комбинированные эстроген-прогестагенные контрацептивы и комбинированная эстроген-прогестагеновая терапия менопаузы. Всемирная организация здоровья. С. 157, 433–. ISBN 978-92-832-1291-1.
- ^ а б c Кеннет Л. Беккер (2001). Принципы и практика эндокринологии и метаболизма. Липпинкотт Уильямс и Уилкинс. п. 1027. ISBN 978-0-7817-1750-2.
- ^ а б Грегори Ю. Х. Лип; Джон Э. Холл (28 июня 2007 г.). Полная электронная книга по гипертонии. Elsevier Health Sciences. С. 865–. ISBN 978-0-323-07067-6.
- ^ а б Брайан К. Олдридж; Робин Л. Корелли; Майкл Э. Эрнст (1 февраля 2012 г.). Прикладная терапия Кода-Кимбл и Янга: клиническое использование лекарств. Липпинкотт Уильямс и Уилкинс. С. 1072–. ISBN 978-1-60913-713-7.
- ^ «Избранные практические рекомендации США по использованию противозачаточных средств, 2016 г.» (PDF). Рекомендации и отчеты. Vol. 65 нет. 4. Центры по контролю и профилактике заболеваний. 29 июля 2016 г.
- ^ «Избранные практические рекомендации США по использованию противозачаточных средств, 2016 г.» (PDF). Рекомендации и отчеты. Vol. 65 нет. 4. Центры по контролю и профилактике заболеваний. 29 июля 2016 г.
- ^ а б «Медицинские критерии приемлемости для использования противозачаточных средств в США, 2016 г.» (PDF). Рекомендации и отчеты. Vol. 65 нет. 3. Центры по контролю и профилактике заболеваний. 29 июля 2016 г.
- ^ а б c d е ж грамм час я j k л м п Джеффри К. Аронсон (21 февраля 2009 г.). Побочные эффекты Мейлера эндокринных и метаболических препаратов. Эльзевир. С. 177, 219, 223, 224, 230, 232, 239, 242. ISBN 978-0-08-093292-7.
- ^ а б Герстман Б.Б., Пайпер Дж. М., Томита Д. К., Фергюсон В. Дж., Штадел Б. В., Лундин Ф. Э. (январь 1991 г.). «Доза орального контрацептива эстрогена и риск тромбоэмболии глубоких вен». Являюсь. J. Epidemiol. 133 (1): 32–7. Дои:10.1093 / oxfordjournals.aje.a115799. PMID 1983896.
- ^ а б Бенно Руннебаум; Томас Рабе, ред. (17 апреля 2013 г.). «Контразептион». Gynäkologische Endokrinologie und Fortpflanzungsmedizin: Группа 1: Gynäkologische Endokrinologie. Springer-Verlag. С. 411–512. ISBN 978-3-662-07635-4.
- ^ а б Герстман ББ, Гросс Т.П., Кеннеди Д.Л., Беннетт Р.С., Томита Д.К., Штадел Б.В. (январь 1991 г.). «Тенденции в содержании и использовании оральных контрацептивов в США, 1964-88 гг.». Am J Public Health. 81 (1): 90–6. Дои:10.2105 / ajph.81.1.90. ЧВК 1404924. PMID 1983923.
- ^ Галло, MF; Нанда, К; Граймс, Д.А.; Лопес, Л. М.; Шульц, К.Ф. (1 августа 2013 г.). «20 мкг против 20 мкг комбинированных оральных контрацептивов эстрогена для контрацепции». Кокрановская база данных систематических обзоров (8): CD003989. Дои:10.1002 / 14651858.CD003989.pub5. ЧВК 7173696. PMID 23904209.
- ^ Грегори Пинкус (22 октября 2013 г.). Гормоны и атеросклероз: материалы конференции, состоявшейся в Брайтоне, штат Юта, 11-14 марта 1958 г.. Elsevier Science. С. 411–. ISBN 978-1-4832-7064-7.
- ^ Майкл Эттель; Эккехард Шиллингер (6 декабря 2012 г.). Эстрогены и антиэстрогены II: фармакология и клиническое применение эстрогенов и антиэстрогенов. Springer Science & Business Media. п. 390. ISBN 978-3-642-60107-1.
- ^ а б Марианна Дж. Легато (29 октября 2009 г.). Принципы гендерной медицины. Академическая пресса. С. 225–234. ISBN 978-0-08-092150-1.
- ^ а б Пол Д. Стейн (5 апреля 2016 г.). Легочная эмболия. Вайли. С. 187–. ISBN 978-1-119-03909-9.
- ^ а б c d е ж грамм час я Пфайфер, Саманта; Баттс, Саманта; Думесик, Даниэль; Фоссум, Грегори; Грасиа, Клариса; Ла Барбера, Эндрю; Мерсеро, Дженнифер; Одем, Рэндалл; Пензиас, Алан; Писарская, Маргарета; Ребар, Роберт; Рейндоллар, Ричард; Розен, Митчелл; Сэндлоу, Джей; Сокол, Ребекка; Вернон, Майкл; Видра, Эрик (январь 2017 г.). «Комбинированная гормональная контрацепция и риск венозной тромбоэмболии: руководство». Fertil. Стерил. 107 (1): 43–51. Дои:10.1016 / j.fertnstert.2016.09.027. PMID 27793376.
- ^ а б c Plu-Bureau G, Maitrot-Mantelet L, Hugon-Rodin J, Canonico M (февраль 2013 г.). «Гормональные контрацептивы и венозная тромбоэмболия: обновление эпидемиологии». Best Pract. Res. Clin. Эндокринол. Метаб. 27 (1): 25–34. Дои:10.1016 / j.beem.2012.11.002. PMID 23384743.
- ^ Кинан, Линн; Керр, Тайсон; Дуэйн, Маргарита; Ван Ганди, Карл (2019). «Систематический обзор гормональной контрацепции и риска венозного тромбоза». Ежеквартальный журнал Linacre. 85 (4): 470–477. Дои:10.1177/0024363918816683. ISSN 0024-3639. ЧВК 6322116. PMID 32431379.
- ^ а б c d е Томмазо Фальконе; Уильям В. Херд (2007). Клиническая репродуктивная медицина и хирургия. Elsevier Health Sciences. С. 388–. ISBN 978-0-323-03309-1.
- ^ Кристен-Мэтр С (2017). «Использование замены гормонов у женщин с эндокринными заболеваниями». Horm Res Paediatr. 87 (4): 215–223. Дои:10.1159/000457125. PMID 28376481.
- ^ Кеннет Л. Беккер (2001). Принципы и практика эндокринологии и метаболизма. Липпинкотт Уильямс и Уилкинс. С. 1024, 1027, 1035, 2153. ISBN 978-0-7817-1750-2.
Низкие дозы КОК содержат <50 мкг эстрогена и являются основным препаратом выбора для пероральной контрацепции. КОК, содержащие ≥50 мкг эстрогена, больше не следует регулярно использовать для контрацепции. [...] Эстрогеновый компонент КОК может вызвать ощущение полноты и болезненности груди.
- ^ Комитет по взаимосвязи между оральными контрацептивами и раком груди (1 января 1991 г.). Оральные контрацептивы и рак груди. Национальные академии. С. 143–. ISBN 9780309044936. НАП: 13774.
Следуя рекомендации своего Консультативного комитета по лекарственным средствам для фертильности и материнского здоровья, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) недавно приказало удалить с рынка все оральные контрацептивы с содержанием [этинилэстрадиола] более 50 мкг.
- ^ Исследование репродуктивной токсикологии с участием нескольких поколений этинилэстрадиола (CAS № 57636) у крыс SpragueDawley (исследования кормов). Издательство ДИАНА. С. 27–. ISBN 978-1-4379-4231-6.
Препараты для пероральных контрацептивов, содержащие более 50 мкг этинилэстрадиола, были сняты с рынка США в 1989 году, и в настоящее время представленные на рынке препараты обычно содержат от 20 до 35 мкг этинилэстрадиола.
- ^ Sitruk-Ware R (ноябрь 2016 г.). «Гормональная контрацепция и тромбоз». Fertil. Стерил. 106 (6): 1289–1294. Дои:10.1016 / j.fertnstert.2016.08.039. PMID 27678035.
- ^ Галло, MF; Нанда, К; Граймс, Д.А.; Лопес, Л. М.; Шульц, К.Ф. (1 августа 2013 г.). «20 мкг против 20 мкг комбинированных оральных контрацептивов эстрогена для контрацепции». Кокрановская база данных систематических обзоров (8): CD003989. Дои:10.1002 / 14651858.CD003989.pub5. ЧВК 7173696. PMID 23904209.
- ^ а б c Одлинд В, Милсом I, Перссон I, Виктор А (июнь 2002 г.). «Могут ли изменения глобулина, связывающего половые гормоны, предсказать риск венозной тромбоэмболии при применении комбинированных оральных контрацептивов?». Acta Obstet Gynecol Scand. 81 (6): 482–90. PMID 12047300.
- ^ Рапс М., Хелмерхорст Ф., Флейшер К., Томассен С., Розендал Ф., Розинг Дж., Баллиё Б., Ван Влит Х (июнь 2012 г.). «Глобулин, связывающий половые гормоны, как маркер тромботического риска гормональных контрацептивов». J. Thromb. Haemost. 10 (6): 992–7. Дои:10.1111 / j.1538-7836.2012.04720.x. PMID 22469296. S2CID 20803995.
- ^ Станчик Ф.З., Граймс Д.А. (сентябрь 2008 г.). «Глобулин, связывающий половые гормоны: не суррогатный маркер венозной тромбоэмболии у женщин, использующих оральные контрацептивы». Контрацепция. 78 (3): 201–3. Дои:10.1016 / j.contraception.2008.04.004. PMID 18692609.
- ^ а б c Стивен Дж. Уинтерс; Илпо Т. Хухтаниеми (25 апреля 2017 г.). Мужской гипогонадизм: основные, клинические и терапевтические принципы. Humana Press. С. 307–. ISBN 978-3-319-53298-1.
- ^ Notelovitz M (март 2006 г.). «Клиническое заключение: биологические и фармакологические принципы терапии эстрогенами при симптоматической менопаузе». МедГенМед. 8 (1): 85. ЧВК 1682006. PMID 16915215.
- ^ Goodman MP (февраль 2012 г.). «Все ли эстрогены созданы равными? Обзор пероральной и трансдермальной терапии». J Womens Health (Larchmt). 21 (2): 161–9. Дои:10.1089 / jwh.2011.2839. PMID 22011208.
- ^ а б Стеге Р., Карлстрём К., Коллсте Л., Эрикссон А., Хенрикссон П., Пусетт А. (1988). «Терапия одиночным лекарственным средством полиэстрадиолфосфата при раке простаты». Являюсь. J. Clin. Онкол. 11 Приложение 2: S101–3. Дои:10.1097/00000421-198801102-00024. PMID 3242384. S2CID 32650111.
- ^ а б c d е фон Шульц Б., Карлстрём К., Коллсте Л., Эрикссон А., Хенрикссон П., Пусетт А., Стеге Р. (1989). «Эстрогеновая терапия и функция печени - метаболические эффекты при пероральном и парентеральном введении». Предстательная железа. 14 (4): 389–95. Дои:10.1002 / pros.2990140410. PMID 2664738. S2CID 21510744.
- ^ а б c Ottosson UB, Carlström K, Johansson BG, von Schoultz B (1986). «Индукция эстрогеном белков печени и холестерина липопротеинов высокой плотности: сравнение валерата эстрадиола и этинилэстрадиола». Гинеколь. Акушерство. Вкладывать деньги. 22 (4): 198–205. Дои:10.1159/000298914. PMID 3817605.
- ^ а б Туро Р., Смольски М., Эслер Р., Куджава М.Л., Бромаж С.Дж., Окли Н., Адейоджу А., Браун С.К., Бро Р., Синклер А., Коллинз Г.Н. (февраль 2014 г.). «Диэтилстильбоэстрол для лечения рака простаты: прошлое, настоящее и будущее» (PDF). Сканд Дж Урол. 48 (1): 4–14. Дои:10.3109/21681805.2013.861508. PMID 24256023. S2CID 34563641.
- ^ а б c d е ж грамм Филлипс И., Шах С.И., Дуонг Т., Абель П., Лэнгли Р.Е. (2014). «Андрогенная депривационная терапия и повторное появление парентерального эстрогена при раке простаты». Онкол Гематол Рев. 10 (1): 42–47. Дои:10.17925 / ohr.2014.10.1.42. ЧВК 4052190. PMID 24932461.
- ^ а б c Ваун Ки Хонг; Джеймс Ф. Холланд (2010). Онкологическая медицина Holland-Frei 8. PMPH-США. С. 753–. ISBN 978-1-60795-014-1.
- ^ а б c Рассел Н., Чунг А., Гроссманн М. (август 2017 г.). «Эстрадиол для смягчения побочных эффектов терапии андрогенной депривации». Endocr. Relat. Рак. 24 (8): R297 – R313. Дои:10.1530 / ERC-17-0153. PMID 28667081.
- ^ Майкл Траунер; Питер Л. М. Янсен (2004). Молекулярный патогенез холестаза. Springer Science & Business Media. С. 260–. ISBN 978-0-306-48240-3.
- ^ а б Пьер-Ален Клавьен; Джон Бэйли (15 апреля 2008 г.). Заболевания желчного пузыря и желчных протоков: диагностика и лечение. Джон Вили и сыновья. С. 363–. ISBN 978-0-470-98697-4.
- ^ Питер Дж. О'Брайен; Уильям Роберт Брюс (2010). Эндогенные токсины: диета, генетика, болезни и лечение. Джон Вили и сыновья. С. 302–. ISBN 978-3-527-32363-0.
- ^ а б c А. Блауштайн (11 ноября 2013 г.). Патология женских половых путей. Springer Science & Business Media. С. 291–. ISBN 978-1-4757-1767-9.
- ^ Эрл А. Сурвит; Дэвид Альбертс (6 декабря 2012 г.). Рак эндометрия. Springer Science & Business Media. С. 11–. ISBN 978-1-4613-0867-6.
- ^ а б c Кидд, Карен А .; Бланчфилд, Пол Дж .; Миллс, Кеннет Х .; Palace, Vince P .; Эванс, Роберт Э .; Lazorchak, Джеймс М .; Флик, Роберт В. (22 мая 2007 г.). «Коллапс популяции рыб после воздействия синтетического эстрогена». Труды Национальной академии наук. 104 (21): 8897–8901. Bibcode:2007PNAS..104.8897K. Дои:10.1073 / pnas.0609568104. ISSN 0027-8424. ЧВК 1874224. PMID 17517636.
- ^ а б c Парк, Брэдли Дж .; Кидд, Карен (2005). «Влияние синтетического эстрогена этинилэстрадиола на ранние стадии жизни норковых и зеленых лягушек в дикой природе и на месте». Экологическая токсикология и химия. 24 (8): 2027–2036. Дои:10.1897 / 04-227R.1. ISSN 1552-8618. PMID 16152976.
- ^ Ван, Бонни; Санчес, Роза I .; Франклин, Рональд Б.; Эванс, Дэвид С .; Хаски, Су-Эр В. (ноябрь 2004 г.). «Участие CYP3A4 и CYP2C9 в метаболизме 17 альфа-этинилэстрадиола». Метаболизм и утилизация лекарств. 32 (11): 1209–1212. Дои:10.1124 / дмд.104.000182. ISSN 0090-9556. PMID 15304426. S2CID 86245855.
- ^ а б c d е ж грамм час я Чжан Х, Цуй Д., Ван Б., Хань Й. Х., Балимане П., Ян З., Синз М., Родригес А. Д. (2007). «Фармакокинетические лекарственные взаимодействия с участием 17альфа-этинилэстрадиола: новый взгляд на старое лекарство». Клин Фармакокинет. 46 (2): 133–57. Дои:10.2165/00003088-200746020-00003. PMID 17253885. S2CID 71784426.
- ^ Escande A, Pillon A, Servant N, Cravedi JP, Larrea F, Muhn P, Nicolas JC, Cavaillès V, Balaguer P (2006). «Оценка селективности лиганда с использованием линий репортерных клеток, стабильно экспрессирующих рецептор эстрогена альфа или бета». Biochem. Pharmacol. 71 (10): 1459–69. Дои:10.1016 / j.bcp.2006.02.002. PMID 16554039.
- ^ Jeyakumar M, Carlson KE, Gunther JR, Katzenellenbogen JA (апрель 2011 г.). «Исследование параметров эстрогеновой активности: анализ сродства связывания лиганда и коактиватора». J. Biol. Chem. 286 (15): 12971–82. Дои:10.1074 / jbc.M110.205112. ЧВК 3075970. PMID 21321128.
- ^ Просниц Э. Р., Артерберн Дж. Б. (июль 2015 г.). «Международный союз фундаментальной и клинической фармакологии. XCVII. G-белковый рецептор эстрогена и его фармакологические модуляторы». Pharmacol. Rev. 67 (3): 505–40. Дои:10.1124 / пр.114.009712. ЧВК 4485017. PMID 26023144.
- ^ Йетс М.А., Ли И, Члебек П.Дж., Оффнер Х. (2010). «GPR30, но не рецептор эстрогена-альфа, имеет решающее значение в лечении экспериментального аутоиммунного энцефаломиелита пероральным этинилэстрадиолом». BMC Immunol. 11: 20. Дои:10.1186/1471-2172-11-20. ЧВК 2864220. PMID 20403194.
- ^ Просниц Э. Р., Бартон М (2011). «Связанный с G-белком рецептор эстрогена GPER в здоровье и болезни». Нат Рев Эндокринол. 7 (12): 715–26. Дои:10.1038 / nrendo.2011.122. ЧВК 3474542. PMID 21844907.
Дальнейшие исследования показали, что терапевтический эффект этинилэстрадиола при установленном EAE опосредован через GPER, но не через ERα, и, возможно, связан с выработкой противовоспалительного цитокина Il ‑ 10.115
- ^ Просниц Э. Р., Бартон М (2014). «Биология эстрогенов: новое понимание функции GPER и клинических возможностей». Мол. Клетка. Эндокринол. 389 (1–2): 71–83. Дои:10.1016 / j.mce.2014.02.002. ЧВК 4040308. PMID 24530924.
Кроме того, было продемонстрировано, что терапевтический эффект этинилэстрадиола при установленном заболевании требует экспрессии GPER, но не ERα, и был связан с выработкой противовоспалительного цитокина IL-10 (Yates et al., 2010).
- ^ Quaynor SD, Stradtman EW, Kim HG, Shen Y, Chorich LP, Schreihofer DA, Layman LC (июль 2013 г.). «Задержка полового созревания и резистентность к эстрогену у женщины с вариантом рецептора эстрогена α». Медицинский журнал Новой Англии. 369 (2): 164–71. Дои:10.1056 / NEJMoa1303611. ЧВК 3823379. PMID 23841731.
- ^ Чарльз Р. Крейг; Роберт Э. Штицель (2004). Современная фармакология с клиническим применением. Липпинкотт Уильямс и Уилкинс. С. 708–. ISBN 978-0-7817-3762-3.
- ^ Гаутам Аллахбадия; Рина Агравал (2007). Синдром поликистоза яичников. Аньшань. С. 257–. ISBN 978-1-904798-74-3.
- ^ а б Виктор Гомель; Малькольм Г. Манро; Тимоти С. Роу (1990). Гинекология: практический подход. Уильямс и Уилкинс. п. 132 134. ISBN 978-0-683-03631-2.
Синтетический эстроген, этинилэстрадиол, более широко используемый в пероральных контрацептивах, имеет биологическую активность в 100 раз больше, чем нативные и конъюгированные вещества.
- ^ а б Донна Шоуп (7 ноября 2007 г.). Справочник по контрацепции: руководство по практическому ведению. Springer Science & Business Media. С. 23–. ISBN 978-1-59745-150-5.
EE2 примерно в 100 раз эффективнее конъюгированного конъюгированного эстрогена лошади или сульфата эстрона для стимуляции синтеза белков печени. [...] EE2 примерно в 1,7 раза эффективнее местранола того же веса.
- ^ Натаниэль МакКонаги (21 ноября 2013 г.). Сексуальное поведение: проблемы и управление. Springer Science & Business Media. С. 177–. ISBN 978-1-4899-1133-9.
Meyer et al. обнаружили, что этинилэстрадиол был в 75-100 раз более активным, чем конъюгированный эстроген, на основе доз, необходимых для понижения уровня тестостерона до уровня взрослой женщины, при этом необходимы 0,1 мг первого и 7,5-10 мг второго.
- ^ Брюс Чабнер; Дэн Луи Лонго (1996). Химиотерапия и биотерапия рака: принципы и практика. Издательство Lippincott-Raven. п. 186. ISBN 978-0-397-51418-2.
Относительная эффективность некоторых эстрогенов была проанализирована путем определения воздействия на ФСГ в плазме, измерения системного эффекта, а также путем увеличения уровней SHBG, CBG и ангиотензиногена, все из которых указывают на печеночный эффект. Пиперазинэстрона сульфат и микронизированный эстрадиол были равноценны в отношении увеличения SHBG, тогда как конъюгированные эстрогены были в 3,2 раза сильнее, DES в 28,4 раза сильнее, а этинилэстрадиол в 600 раз сильнее. Что касается снижения ФСГ, конъюгированные эстрогены были в 1,4 раза, DES в 3,8 раза, а этинилэстрадиол был в 80-200 раз сильнее, чем сульфат пиперазина эстрона.
- ^ а б Мащак С.А., Лобо Р.А., Дозоно-Такано Р., Эггена П., Накамура Р.М., Бреннер П.Ф., Мишелл Д.Р. (ноябрь 1982 г.). «Сравнение фармакодинамических свойств различных препаратов эстрогенов». Являюсь. J. Obstet. Гинеколь. 144 (5): 511–8. Дои:10.1016/0002-9378(82)90218-6. PMID 6291391.
- ^ Лауритцен С (сентябрь 1990 г.). «Клиническое применение эстрогенов и прогестагенов». Maturitas. 12 (3): 199–214. Дои:10.1016 / 0378-5122 (90) 90004-П. PMID 2215269.
- ^ Лауритцен С (июнь 1977 г.). «[Эстрогеновая терапия на практике. 3. Эстрогеновые препараты и комбинированные препараты]» [Эстрогеновая терапия на практике. 3. Препараты эстрогенов и комбинированные препараты. Fortschritte Der Medizin (на немецком). 95 (21): 1388–92. PMID 559617.
- ^ Wolf AS, Schneider HP (12 марта 2013 г.). Эстроген в диагностике и терапии. Springer-Verlag. С. 78–. ISBN 978-3-642-75101-1.
- ^ Göretzlehner G, Lauritzen C, Römer T, Rossmanith W (1 января 2012 г.). Praktische Hormontherapie in der Gynäkologie. Вальтер де Грюйтер. С. 44–. ISBN 978-3-11-024568-4.
- ^ Knörr K, Beller FK, Lauritzen C (17 апреля 2013 г.). Lehrbuch der Gynäkologie. Springer-Verlag. С. 212–213. ISBN 978-3-662-00942-0.
- ^ Horský J, Presl J (1981). «Гормональное лечение нарушений менструального цикла». В Horsky J, Presl J (ред.). Функция яичников и ее нарушения: диагностика и лечение. Springer Science & Business Media. С. 309–332. Дои:10.1007/978-94-009-8195-9_11. ISBN 978-94-009-8195-9.
- ^ Pschyrembel W (1968). Praktische Gynäkologie: für Studierende und Ärzte. Вальтер де Грюйтер. С. 598–599. ISBN 978-3-11-150424-7.
- ^ Lauritzen CH (январь 1976 г.). «Женский климактерический синдром: значение, проблемы, лечение». Acta Obstetricia Et Gynecologica Scandinavica. Добавка. 51: 47–61. Дои:10.3109/00016347509156433. PMID 779393.
- ^ Лауритцен С (1975). «Женский климактерический синдром: значение, проблемы, лечение». Acta Obstetricia et Gynecologica Scandinavica. 54 (s51): 48–61. Дои:10.3109/00016347509156433. ISSN 0001-6349.
- ^ Копера Х (1991). «Гормон дер Гонаден». Hormonelle Therapie für die Frau. Kliniktaschenbücher. С. 59–124. Дои:10.1007/978-3-642-95670-6_6. ISBN 978-3-540-54554-5. ISSN 0172-777X.
- ^ Скотт В.В., Менон М., Уолш П.К. (апрель 1980 г.). «Гормональная терапия рака простаты». Рак. 45 Дополнение 7: 1929–1936. Дои:10.1002 / cncr.1980.45.s7.1929. PMID 29603164.
- ^ Leinung MC, Feustel PJ, Joseph J (2018). «Гормональное лечение трансгендерных женщин пероральным эстрадиолом». Трансгендерное здоровье. 3 (1): 74–81. Дои:10.1089 / trgh.2017.0035. ЧВК 5944393. PMID 29756046.
- ^ Райден А.Б. (1950). «Натуральные и синтетические эстрогенные вещества; их относительная эффективность при пероральном применении». Acta Endocrinologica. 4 (2): 121–39. Дои:10.1530 / acta.0.0040121. PMID 15432047.
- ^ Райден А.Б. (1951). «Эффективность натуральных и синтетических эстрогенных веществ у женщин». Acta Endocrinologica. 8 (2): 175–91. Дои:10.1530 / acta.0.0080175. PMID 14902290.
- ^ Коттмайер HL (1947). "Ueber blutungen in der menopause: Speziell der klinischen bedeutung eines endometriums mit zeichen гормональный агент beeinflussung: Часть I". Acta Obstetricia et Gynecologica Scandinavica. 27 (s6): 1–121. Дои:10.3109/00016344709154486. ISSN 0001-6349.
Нет сомнений в том, что преобразование эндометрия с помощью инъекций как синтетических, так и нативных препаратов эстрогенных гормонов удается, но мнение разных авторов о том, могут ли нативные пероральные препараты вызывать пролиферацию слизистой оболочки, меняется. PEDERSEN-BJERGAARD (1939) смог показать, что 90% фолликулина, попадающего в кровь портовой вены, инактивируется в печени. Ни KAUFMANN (1933, 1935), ни RAUSCHER (1939, 1942), ни HERRNBERGER (1941) не смогли довести кастрационный эндометрий до пролиферации с помощью больших доз перорально вводимых препаратов эстрона или эстрадиола. Другие результаты сообщаются NEUSTAEDTER (1939), LAUTERWEIN (1940) и FERIN (1941); им удалось превратить атрофический кастрационный эндометрий в слизистую с однозначной пролиферацией с помощью 120–300 эстрадиола или 380 эстрона.
- ^ Rietbrock N, Staib AH, Loew D (11 марта 2013 г.). Клиническая фармакология: Arzneitherapie. Springer-Verlag. С. 426–. ISBN 978-3-642-57636-2.
- ^ Мартинес-Манауту Дж., Рудель Х.В. (1966). «Антиовуляторная активность некоторых синтетических и природных эстрогенов». В Роберте Бенджамине Гринблатте (ред.). Овуляция: стимуляция, подавление и обнаружение. Липпинкотт. С. 243–253.
- ^ Герр Ф., Ревес С., Мэнсон А.Дж., Джуэлл Дж. Б. (1970). «Биологические свойства сульфатов эстрогенов». Химические и биологические аспекты конъюгации стероидов. С. 368–408. Дои:10.1007/978-3-642-49793-3_8. ISBN 978-3-642-49506-9.
- ^ Дункан CJ, Кистнер RW, Мэнселл H (октябрь 1956 г.). «Подавление овуляции трип-анизилхлорэтиленом (ТАХЭ)». Акушерство и гинекология. 8 (4): 399–407. PMID 13370006.
- ^ а б c Ширер Р.Дж., Хендри В.Ф., Соммервилл И.Ф., Фергюссон Д.Д. (декабрь 1973 г.). "Тестостерон плазмы: точный монитор гормонального лечения рака простаты". Br J Urol. 45 (6): 668–77. Дои:10.1111 / j.1464-410x.1973.tb12238.x. PMID 4359746.
- ^ а б c Экбак, Мария Пальметун (2017). "Гирсутизм, что делать?" (PDF). Международный журнал эндокринологии и метаболических нарушений. 3 (3). Дои:10.16966 / 2380-548X.140. ISSN 2380-548X.
- ^ а б c Эберхард Нишлаг; Герман М. Бере; Сьюзан Нишлаг (26 июля 2012 г.). Тестостерон: действие, дефицит, замещение. Издательство Кембриджского университета. С. 62–. ISBN 978-1-107-01290-5.
- ^ Косс С.К., Джонс А., Парк Д.Н., Нараянан Р., Барретт С.М., Кирби Д.Д., Веверка К.А., Миллер Д.Д., Мортон Р.А., Штайнер М.С., Далтон Дж.Т. (2012). «Доклиническая характеристика нового селективного агониста ERα дифенилбензамида для гормональной терапии рака простаты». Эндокринология. 153 (3): 1070–81. Дои:10.1210 / en.2011-1608. PMID 22294742.
- ^ Рич П. (2008). «Гормональные противозачаточные средства от прыщей». Кутис. 81 (1 приложение): 13–8. PMID 18338653.
- ^ Ян Л.П., Плоскер Г.Л. (2012). «Номегестрола ацетат / эстрадиол: в пероральной контрацепции». Наркотики. 72 (14): 1917–28. Дои:10.2165/11208180-000000000-00000. PMID 22950535. S2CID 44335732.
- ^ а б Якоби Г. Х., Альтвейн Дж. Э., Курт К. Х., Бастинг Р., Хоэнфеллнер Р. (1980). «Лечение распространенного рака предстательной железы парентеральным ципротерона ацетатом: рандомизированное исследование фазы III». Br J Urol. 52 (3): 208–15. Дои:10.1111 / j.1464-410x.1980.tb02961.x. PMID 7000222.
- ^ а б Gunnarsson PO, Norlén BJ (1988). «Клиническая фармакология полиэстрадиолфосфата». Предстательная железа. 13 (4): 299–304. Дои:10.1002 / pro.2990130405. PMID 3217277. S2CID 33063805.
- ^ Шталь Ф., Шнорр Д., Бэр С.М., Фрёлих Г., Дёрнер Г. (1989). «Подавление уровня андрогенов в плазме с помощью комбинированной терапии депо-эстрогеном (Туристерон) и дексаметазоном у пациентов с раком простаты». Exp. Clin. Эндокринол. 94 (3): 239–43. Дои:10.1055 / с-0029-1210905. PMID 2630306.
- ^ а б c Дж. Ларри Джеймсон; Лесли Дж. Де Гроот (18 мая 2010 г.). Эндокринология - Электронная книга: для взрослых и детей. Elsevier Health Sciences. С. 2282–. ISBN 978-1-4557-1126-0.
- ^ Луи Дж. Дени; Кейт Гриффитс; Амир В Кайсари; Джеральд П. Мерфи (1 марта 1999 г.). Учебник рака простаты: патология, диагностика и лечение: патология, диагностика и лечение. CRC Press. С. 297–. ISBN 978-1-85317-422-3.
- ^ Скотт В.В., Менон М., Уолш П.К. (апрель 1980 г.). «Гормональная терапия рака простаты». Рак. 45 Дополнение 7: 1929–1936. Дои:10.1002 / cncr.1980.45.s7.1929. PMID 29603164. S2CID 4492779.
- ^ Бингель А.С., Бенуа П.С. (февраль 1973 г.). «Оральные контрацептивы: терапия против побочных реакций, с перспективой на будущее I». J Pharm Sci. 62 (2): 179–200. Дои:10.1002 / jps.2600620202. PMID 4568621.
- ^ Н. Ритброк; А. Х. Стаиб; Д. Лоу (11 марта 2013 г.). Клиническая фармакология: Arzneitherapie. Springer-Verlag. С. 426–. ISBN 978-3-642-57636-2.
- ^ Элгер, Уолтер (1972). «Физиология и фармакология женского воспроизводства в аспекте контроля фертильности». Обзоры физиологии, биохимии и экспериментальной фармакологии, том 67. Ergebnisse der Physiologie Reviews of Physiology. 67. С. 69–168. Дои:10.1007 / BFb0036328. ISBN 3-540-05959-8. PMID 4574573.
- ^ Бастианелли, Карло; Фаррис, Мануэла; Розато, Елена; Бросенс, Иво; Бенаджиано, Джузеппе (2018). «Фармакодинамика комбинированных эстроген-прогестиновых оральных контрацептивов 3. Подавление овуляции». Обзор клинической фармакологии. 11 (11): 1085–1098. Дои:10.1080/17512433.2018.1536544. ISSN 1751-2433. PMID 30325245. S2CID 53246678.
- ^ Хорхе Мартинес-Манауту; Гарри В. Рудель (1966). «Антиовуляторная активность некоторых синтетических и природных эстрогенов». В Роберте Бенджамине Гринблатте (ред.). Овуляция: стимуляция, подавление и обнаружение. Липпинкотт. С. 243–253.
- ^ Herr, F .; Revesz, C .; Мэнсон, А. Дж .; Джуэлл, Дж. Б. (1970). «Биологические свойства сульфатов эстрогенов». Химические и биологические аспекты конъюгации стероидов. С. 368–408. Дои:10.1007/978-3-642-49793-3_8. ISBN 978-3-642-49506-9.
- ^ Goldzieher JW, Pena A, Chenault CB, Woutersz TB (июль 1975 г.). «Сравнительные исследования этинилэстрогенов, используемых в оральных контрацептивах. II. Антиовуляторная активность». Являюсь. J. Obstet. Гинеколь. 122 (5): 619–24. Дои:10.1016/0002-9378(75)90061-7. PMID 1146927.
- ^ а б c Эндрю Н. Маргиорис; Джордж П. Хрусос (20 апреля 2001 г.). Заболевания надпочечников. Springer Science & Business Media. С. 84–. ISBN 978-1-59259-101-5.
- ^ а б c Полдерман К. Х., Гурен Л. Дж., Ван дер Вин Э. А. (октябрь 1995 г.). «Влияние гонадных андрогенов и эстрогенов на уровень андрогенов надпочечников». Clin. Эндокринол. (Oxf). 43 (4): 415–21. Дои:10.1111 / j.1365-2265.1995.tb02611.x. PMID 7586614. S2CID 6815423.
- ^ Trémollieres F (февраль 2012 г.). "Противозачаточные или эстрогестивные средства: quelle différence entre éthinylestradiol et эстрадиол?" [Комбинированная пероральная контрацепция: есть ли разница между этинилэстрадиолом и эстрадиолом?]. Gynecol Obstet Fertil (На французском). 40 (2): 109–15. Дои:10.1016 / j.gyobfe.2011.10.009. PMID 22244780.
- ^ а б c Рожерио А. Лобо (5 июня 2007 г.). Лечение женщины в постменопаузе: основные и клинические аспекты. Академическая пресса. С. 177, 770–771. ISBN 978-0-08-055309-2.
- ^ Донна Шоуп (10 февраля 2011 г.). Контрацепция. Джон Вили и сыновья. С. 79–. ISBN 978-1-4443-4263-5.
- ^ Ситрук-Вэр Р., Нат А (2011). «Метаболические эффекты противозачаточных стероидов». Rev Endocr Metab Disord. 12 (2): 63–75. Дои:10.1007 / s11154-011-9182-4. PMID 21538049. S2CID 23760705.
- ^ а б c Бойд Р.А., Зегарак Е.А., Элдон М.А. (январь 2003 г.). «Влияние пищи на биодоступность норэтиндрона и этинилэстрадиола из таблеток норэтиндронацетата / этинилэстрадиола, предназначенных для непрерывной заместительной гормональной терапии». J Clin Pharmacol. 43 (1): 52–8. Дои:10.1177/0091270002239706. PMID 12520628. S2CID 27729272.
- ^ а б Дэвид Додик; Стивен Д. Зильберштейн; Стивен Зильберштейн (2016). Мигрень. Издательство Оксфордского университета. С. 272–. ISBN 978-0-19-979361-7.
- ^ а б c Орм М.Л., Бэк-диджей, Брекенридж А.М. (1983). «Клиническая фармакокинетика пероральных противозачаточных стероидов». Клин Фармакокинет. 8 (2): 95–136. Дои:10.2165/00003088-198308020-00001. PMID 6342899. S2CID 43298472.
- ^ а б М. Нотеловиц; П.А. ван Кип (6 декабря 2012 г.). Климактерический период в перспективе: материалы Четвертого Международного конгресса по менопаузе, проходившего в Лейк-Буэна-Виста, Флорида, 28 октября - 2 ноября 1984 г.. Springer Science & Business Media. С. 395–. ISBN 978-94-009-4145-8.
- ^ Пугеат М.М., Данн Дж. Ф., Нисула BC (июль 1981 г.). «Транспорт стероидных гормонов: взаимодействие 70 препаратов с тестостерон-связывающим глобулином и кортикостероид-связывающим глобулином в плазме крови человека». J. Clin. Эндокринол. Метаб. 53 (1): 69–75. Дои:10.1210 / jcem-53-1-69. PMID 7195405.
- ^ а б c d Маттисон Д.Р., Карякина Н., Гудман М., LaKind JS (сентябрь 2014 г.). «Фармако- и токсикокинетика отдельных экзогенных и эндогенных эстрогенов: обзор данных и выявление пробелов в знаниях». Крит. Rev. Toxicol. 44 (8): 696–724. Дои:10.3109/10408444.2014.930813. PMID 25099693. S2CID 11212469.
- ^ а б c d е ж грамм час я j k Index Nominum 2000: Международный справочник лекарственных средств. Тейлор и Фрэнсис. Январь 2000. с. 412. ISBN 978-3-88763-075-1.
- ^ Inhoffen, H.H .; Hohlweg, W. (1938). "Neue per os-wirksame weibliche Keimdrüsenhormon-Derivate: 17-Aethinyl-oestradiol und Pregnen-in-on-3-ol-17 (Новые производные женских желез, активные per os: 17α-этинилэстрадиол и прегнен-in-on-3" -ол-17) ». Naturwissenschaften. 26 (6): 96. Bibcode:1938NW ..... 26 ... 96I. Дои:10.1007 / BF01681040. S2CID 46648877.
- ^ Майзель, Альберт К. (1965). Гормональный квест. Нью-Йорк: Рэндом Хаус. OCLC 543168.
- ^ Петров, Владимир (декабрь 1970 г.). «Противозачаточные прогестагены». Chem Rev. 70 (6): 713–26. Дои:10.1021 / cr60268a004. PMID 4098492.
- ^ Снидер, Уолтер (2005). «Аналоги гормонов». Открытие лекарств: история. Хобокен, Нью-Джерси: Джон Уайли и сыновья. стр.188–225. ISBN 978-0-471-89980-8.
- ^ Джерасси, Карл (январь 2006 г.). «Химическое рождение таблетки». Американский журнал акушерства и гинекологии. 194 (1): 290–8. Дои:10.1016 / j.ajog.2005.06.010. PMID 16389046.
- ^ FDA (5 мая 2004 г.). «Schering Corp. et al.. Отзыв одобрения 92 новых заявок на лекарственные препараты и 49 сокращенных заявок на новые лекарственные препараты. Уведомление» (PDF). Федеральный регистр. 69 (87): 25124–30.
- ^ Кантор Э.Б. (сентябрь 1956 г.). «Обзор эстрогенов». Постградская медицина. 20 (3): 224–31. Дои:10.1080/00325481.1956.11691266. PMID 13359169.
- ^ Beller, Fritz K .; Knörr, Карл; Лауритцен, Кристиан; Винн, Ральф М. (1974). "Планирование семьи". Гинекология. С. 189–213. Дои:10.1007/978-1-4615-7128-5_17. ISBN 978-0-387-90087-2.
- ^ Халлер, Дж. (1968). "Die antikonzeptionelle Therapie". Die Gestagene. С. 1125–1178. Дои:10.1007/978-3-642-99941-3_8. ISBN 978-3-642-99942-0.
- ^ а б c d е ж грамм «Этинилэстрадиол - Drugs.com».
- ^ И.К. Мортон; Джудит М. Холл (6 декабря 2012 г.). Краткий словарь фармакологических агентов: свойства и синонимы. Springer Science & Business Media. С. 115–. ISBN 978-94-011-4439-1.
- ^ Американская медицинская ассоциация. Департамент лекарств; Совет по лекарствам (Американская медицинская ассоциация); Американское общество клинической фармакологии и терапии (1 февраля 1977 г.). «Эстрогены, прогестагены, оральные контрацептивы и овуляторные агенты». Оценка лекарств AMA. Издательская группа наук. С. 540–572. ISBN 978-0-88416-175-2.
Этинилэстрадиол [эстинил, феминон, линорал, новестрол, палонил]
- ^ Американское общество больничных фармацевтов. Комитет по фармации и фармацевтике (1983). Формулярная служба американских больниц: двухтомное собрание монографий по лекарствам и другой информации. Американское общество больничных фармацевтов. ISBN 9780930530020.
ЭТИНИЛ ЭСТРАДИОЛ U.S.P. (Эстид®, Эстинил®, Лайнорал®, Менолин®, Новестрол®, Палонил®, Спанестрин®, Илестрол®)
дальнейшее чтение
- Майкл Эттель; Эккехард Шиллингер (6 декабря 2012 г.). Эстрогены и антиэстрогены II: фармакология и клиническое применение эстрогенов и антиэстрогенов. Springer Science & Business Media. С. 4, 10, 15, 165, 247–248, 276–291, 363–408, 424, 514, 540, 543, 581. ISBN 978-3-642-60107-1.
- Kuhl H (2005). «Фармакология эстрогенов и прогестагенов: влияние разных путей введения» (PDF). Климактерический. 8 Дополнение 1: 3–63. Дои:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- Станчик Ф.З., Арчер Д.Ф., Бхавнани Б.Р. (2013). «Этинилэстрадиол и 17β-эстрадиол в комбинированных пероральных контрацептивах: фармакокинетика, фармакодинамика и оценка риска». Контрацепция. 87 (6): 706–27. Дои:10.1016 / j.contraception.2012.12.011. PMID 23375353.
- Маттисон Д.Р., Карякина Н., Гудман М., LaKind JS (сентябрь 2014 г.). «Фармако- и токсикокинетика отдельных экзогенных и эндогенных эстрогенов: обзор данных и выявление пробелов в знаниях». Крит. Rev. Toxicol. 44 (8): 696–724. Дои:10.3109/10408444.2014.930813. PMID 25099693. S2CID 11212469.
